
题目列表(包括答案和解析)
| 元素 | 结构特点及在周期表中的位置 | 单质及化合物的都分性质与用途 |
| 甲 | 在元素周期表中,主族序数等于周期数 | 工业上用电解法冶炼该金属 |
| 乙 | 单质的晶体类型为原子晶体 | 氧化物是工业制普通玻璃的主要原料 |
| 丙 | 原子最外层电子数是最内层电子数的2倍 | 单质存在多种同素异形体 |
| 丁 | 元素能形成两种不同的阴离子 | 丁的一种单质与KI溶液反应生成另一种丁的单质 |
| A、甲、乙、丙、丁 |
| B、丁、甲、乙、丙 |
| C、丙、丁、甲、乙 |
| D、乙、甲、丁、丙 |
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
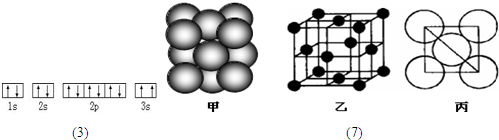


(15分)现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
|
G在周期表的第七列 |
⑴已知BA5 为离子化合物,写出其电子式 .
⑵B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为: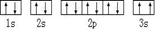
该同学所画的电子排布图违背了 .
⑷G位于 族 区,价电子排布式为 .
⑸DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
⑹检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本模式中的 .

现有四种短周期元素的有关信息如下表所示:
| 元素 | 结构特点及在周期表中的位置 | 单质及化合物的部分性质与用途 |
| 甲 | 在元素周期表中,主族序数等于周期数 | 工业上用电解法冶炼该金属 |
| 乙 | 单质的晶体类型为原子晶体 | 氧化物是工业制普通玻璃的主要原料 |
| 丙 | 原子最外层电子数是最内层电子数的2倍 | 单质存在多种同素异形体 |
| 丁 | 元素能形成两种不同的阴离子 | 丁的一种单质与KI溶液反应生成另一种丁的单质 |
则甲、乙、丙、丁四种元素的原子序数从大到小排列的是 ( )
A.甲、乙、丙、丁 B.丁、甲、乙、丙
C.丙、丁、甲、乙 D.乙、甲、丁、丙
(15分)现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
⑴已知BA5 为离子化合物,写出其电子式 .
⑵B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为:
该同学所画的电子排布图违背了 .
⑷G位于 族 区,价电子排布式为 .
⑸DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
⑹检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本模式中的 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com