X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为34 |
(1)XY
2是一种常用的溶剂,XY
2的分子中存在
2
2
个σ键.YZ
2分子中中心原子的价层电子对数为
4
4
.
(2)在H-Y、H-Z两种共价键中,键的极性较强的是
H-Z
H-Z
,键长较长的是
H-Y
H-Y
.
(3)W的基态原子核外电子排布式是
ls22s22p63s23p63d104s1或[Ar]3d104s1
ls22s22p63s23p63d104s1或[Ar]3d104s1
,向含有W
2+的溶液中逐滴加入过量的氨水,现象为
先形成蓝色沉淀,后溶解,溶液呈深蓝色
先形成蓝色沉淀,后溶解,溶液呈深蓝色
,相应的离子方程式为
Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,
Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,
、
Cu(OH)2+4NH3=〔Cu(NH3)4〕2++2OH-
Cu(OH)2+4NH3=〔Cu(NH3)4〕2++2OH-
.
(4)相同条件下XO
2与YO
2分子在水中溶解度较大是
SO2
SO2
,理由是
CO2是非极性分子,SO2和H2O皆为极性分子,由“相似相溶”原理,SO2在H2O中有较大溶解度
CO2是非极性分子,SO2和H2O皆为极性分子,由“相似相溶”原理,SO2在H2O中有较大溶解度
.
(5)请设计一个实验方案,比较Y、Z单质氧化性的强弱:
在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强
在Na2S溶液中滴加Cl2水,若溶液出现浑浊,说明Cl2的氧化性比S强
.

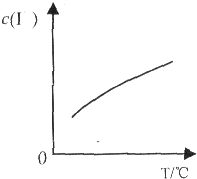 已知:I2与KI溶液发生如下反应:I2(aq)+I-(aq)?I3-(aq),达到平衡后溶液中I-的平衡浓度c(I-)随温度T的变化如图所示.下列有关说法正确的是
已知:I2与KI溶液发生如下反应:I2(aq)+I-(aq)?I3-(aq),达到平衡后溶液中I-的平衡浓度c(I-)随温度T的变化如图所示.下列有关说法正确的是 其电子式为
其电子式为
