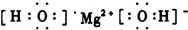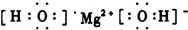(2010?安徽模拟)已知A、B、C、D、E、F、G、H八种元素位于元素周期表前四个周期.A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物.B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同.请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有
离子键、共价键
离子键、共价键
.E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为
3Fe+8H++2NO3-=3Fe2-+2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2-+2NO↑+4H2O
,E的基态离子的电子排布式为
[Ar]3d5、[Ar]3d6
[Ar]3d5、[Ar]3d6
,E
3+与E
2+的稳定性大小为
Fe3+>Fe2+
Fe3+>Fe2+
.
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为
N>O>P>Al
N>O>P>Al
,电负性由小到大的顺序为
Al<P<N<O
Al<P<N<O
.
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的o
-键和π键的数目之比为
4:1
4:1
;F、G对应的氢化物中键能大小为F-H键
>
>
G-H键.
(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为
3:1
3:1
,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为
Al3-+3AlO2-+6H2O=4Al(OH)3↓
Al3-+3AlO2-+6H2O=4Al(OH)3↓
.
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱
2H++SO32-=SO2↑+H2O或H++HSO3-=SO2↑+H2O
2H++SO32-=SO2↑+H2O或H++HSO3-=SO2↑+H2O
.由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液呈酸性,则该溶液中各种离子的浓度由大到小的顺序为
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为
Ba2++2OH-+2HSO3-=BaSO3↓+SO32-+2H2O
Ba2++2OH-+2HSO3-=BaSO3↓+SO32-+2H2O
.

 (2010?湘潭三模)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
(2010?湘潭三模)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).

 (2010?南昌一模)下列物质为中学常见物质,它们具有如下转化关系:对它们有如下的推断:
(2010?南昌一模)下列物质为中学常见物质,它们具有如下转化关系:对它们有如下的推断: