
题目列表(包括答案和解析)
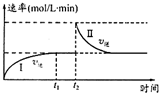 在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图.下列说法正确的是( )
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图.下列说法正确的是( )| A、0~t2时,v正>v逆 | B、Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | C、t2时刻改变的条件可以是向密闭容器中加C | D、Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
【解析】运用守恒原理: Cl2的物质的量与NaOH的物质的量的两倍相等,其余为氢气.
【答案】C
【解析】A的两种溶液中均含Na+、H+、A2-、HA-、OH-,种类相同。
【答案】A
一种新型燃料电池,用两根金属Pt作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应式为X极:CH4+10OH--8e-=CO32—+7H2O; Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的说法中,错误的是
A.X为负极,Y为正极
B.该电池工作时,X极附近溶液的碱性增强
C.在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移
D.工作一段时间后,KOH的物质的量减少
【解析】在原电池中负极失去电子,被氧化,发生氧化反应。正极得到电子,被还原,发生还原反应。根据电极反应式可判断甲烷在X极通入,X是负极,Y是正极。由于甲烷被氧化的同时要消耗溶液中的OH-,所以负极周围溶液的碱性降低。5.6 L O2是![]() ,所以转移的电子是0.25mol×4=1.0mol。将正负极电极反应式相加,即得到总反应式CH4+2OH-+2O2=CO32-+3H2O,所以答案选B。
,所以转移的电子是0.25mol×4=1.0mol。将正负极电极反应式相加,即得到总反应式CH4+2OH-+2O2=CO32-+3H2O,所以答案选B。
两种气态烃组成的混合物0.1mol完全燃烧得0.16mol二氧化碳和3.6克水。下列说法正确的是( )
A.一定是甲烷和乙烯的混合物 B.一定含乙烷,不含甲烷
C.一定含甲烷,不含乙烷 D.一定含甲烷,不能确定是否含有乙烷
【解析】3.6克水是 ,所以根据题意可知该混合气的平均分子组成是C1.6H4,根据平均值原理可知,分子中必须有一种碳原子是1的有机物,在烃中只有甲烷符合。由于甲烷中含有4个氢原子,所以另外一种分子中碳原子数必须大于1,氢原子数是4,符合条件的可以是乙烯或丙炔。所以选项C是正确的,答案选C。
,所以根据题意可知该混合气的平均分子组成是C1.6H4,根据平均值原理可知,分子中必须有一种碳原子是1的有机物,在烃中只有甲烷符合。由于甲烷中含有4个氢原子,所以另外一种分子中碳原子数必须大于1,氢原子数是4,符合条件的可以是乙烯或丙炔。所以选项C是正确的,答案选C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com