
题目列表(包括答案和解析)
A.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中液面
B.分液时分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.容量瓶检漏的操作:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水
D.观察钾元素焰色反应:将铂丝放在稀盐酸中洗涤,然后蘸取固体碳酸钾,置于酒精灯的火焰上进行灼热,透过蓝色钴玻璃进行观察
E.将滴管垂直伸进试管内滴加液体
(2)某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如下图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验验证。
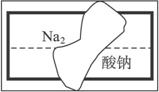
①猜想:这种试剂可能是:_________________________________________________________
②实验验证:_____________________________________________________________________
绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
FeSO4?7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
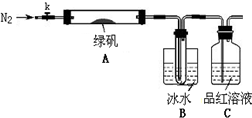
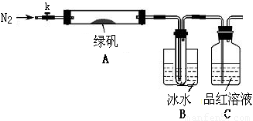 已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
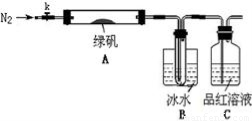
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是?????????????????? ;
结论2:C中溶液褪色,可推知产物中有???? ?????????????? ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足:??????????????????????????? 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是?????????? 。
a.氯水和KSCN溶液???? b.酸性KMnO4溶液????? c.H2O2???? d.NaOH溶液
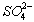
(1)写出图Ⅰ干燥试管里隔绝空气强热硫酸亚铁晶体的化学方程式:?
。?
(2)根据反应原理请你评价图 Ⅰ 实验装置的主要缺点是什么??
。?
(3)试管B中所得液体乙的名称是 ;如何用实验确证乙的阴离子? 。?
(4)怎样检验图Ⅱ装置的气密性? 。
(5)管D在此处的主要作用是 。
(6)根据图Ⅲ试管F中的现象得出的结论是 ;写出C管中发生反应的化学方程式___ 。?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com