
题目列表(包括答案和解析)
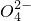 、Cl-等杂质______;
、Cl-等杂质______;| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 加热前质量 | 加热前质量 | 加热后质量 |
| W1(容器) | W2(容器+晶体) | W3(容器+无水硫酸铜) |
| 160(W2-W3) |
| 18(W3-W1) |
| 160(W2-W3) |
| 18(W3-W1) |
| 0.418×2.35 |
| 0.025 |
| 0.418×2.35 |
| 0.025 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com