
题目列表(包括答案和解析)

| ||
| △ |
| ||
| △ |
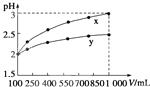 (2010?重庆)pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
(2010?重庆)pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )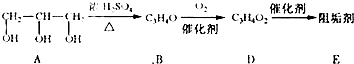
| △ |
| △ |


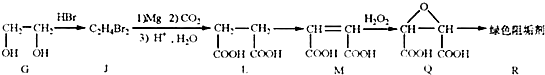
| 催化剂 |
| △ |
| 醇 |
| △ |
| 醇 |
| △ |
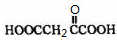 等
等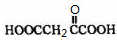 等
等| b |
| t |
| b |
| t |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com