(2013?南京二模)(1)金属材料的使用
①人类进入铁器时代要比青铜器时代晚得多,这与
A
A
有关(填序号).
A.金属的活动性 B.金属的导电性 C.金属的导热性 D.地壳中金属元素的含量
②人类一般使用铜合金多于纯铜,因为铜合金的熔点要比铜低,硬度要比铜
大
大
(填“大”或“小”).
(2)金属的结构
图1是铝的原子结构示意图.在化学反应中铝原子易
失去
失去
(填“得到”或“失去”)电子达到稳定结构,因此化合物中铝元素通常显
+3
+3
价.
(3)金属的活动性
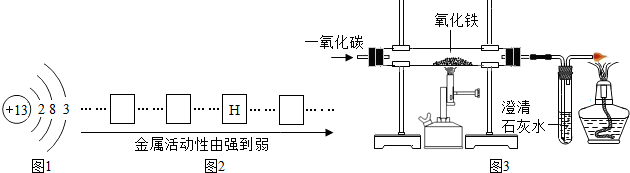
①请将铜、铝、铁三种金属的元素符号填写在下列金属活动性顺序图2中的相应位置.
②要快捷验证铜、铝、铁的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的其它试剂是
AlCl3、CuCl2溶液(答案合理即可)
AlCl3、CuCl2溶液(答案合理即可)
.
③镁、铝、铁三种金属单质与足量的稀硫酸反应,生成等质量的氢气,需要消耗的金属质量由多到少的顺序是
铁>镁>铝
铁>镁>铝
(4)金属的锈蚀
①铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性能,其原因是
铝表面有一层致密的氧化膜
铝表面有一层致密的氧化膜
.
②铁在潮湿的空气中容易锈蚀,为了防止铁制品锈蚀,人们常采用
涂油(答案合理即可)
涂油(答案合理即可)
的方法(任写一种)来达到目的.生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,一段时间后,有无色气泡逸出.溶液变黄的化学反应方程式是:
Fe2O3+6HCl═2FeCl3+3H2O
Fe2O3+6HCl═2FeCl3+3H2O
.
③铜表面也容易生锈成铜绿,其主要成分是碱式碳酸铜[Cu
2(OH)
2CO
3].铜生锈除了与氧气和水有关外,还与空气中的
CO2
CO2
有关.
(5)金属的冶炼
①西汉时期我国的劳动人民又发明了“湿法炼铜”,即“曾青得铁则化为铜”请用反应方程式表示其冶炼原因
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
_.
②小章同学准备在实验室用图3所示装置模拟工业炼铁.请你据此回答:
实验中玻璃管内的现象为:
红色固体变黑色
红色固体变黑色
,反应的化学方程式是
;
③某同学实验完成后,发现过量的澄清石灰水增重0.88g,则该同学通入装置的CO气体质量一定要大于
0.56g
0.56g
g(保留小数点后两位).