
题目列表(包括答案和解析)

A.浓H2SO4 B.浓盐酸 C.食盐 D.二氧化锰 E.KMnO4 F.H2O2
(1)若要快速制备Cl2应选择______________________________________________;
(2)若要快速制备少量HCl,应选择________________________________________;
(3)若要快速制备少量O2,应选择__________________________________________。
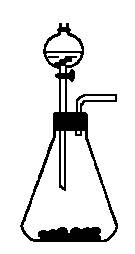
如右图是一套实验室制取气体的装置。某课外活动小组利用这套装置快速制取Cl2、HCl和O2。供选用的试剂有:

A.浓H2SO4 B.浓盐酸 C.食盐 D.二氧化锰 E.KMnO4 F.H2O2
(1)若要快速制备Cl2应选择______________________________________________;
(2)若要快速制备少量HCl,应选择________________________________________;
(3)若要快速制备少量O2,应选择__________________________________________。

A.浓H2SO4 B.浓盐酸 C.食盐 D.二氧化锰 E.KMnO4 F.H2O2
(1)若要快速制备Cl2应选择______________________________________________;
(2)若要快速制备少量HCl,应选择________________________________________;
(3)若要快速制备少量O2,应选择__________________________________________。
(1)若要快速制备少量氧气,应选择________(填答案标号)。
(2)若要快速制少量HCl,应选择________(填答案标号)。
如图所示是一套实验室制气装置,某课外活动小组欲利用这套装置快速制取氧气和氯化氢气体。供选用的试剂有:A.浓H2SO4,B.浓HCl,C.食醋,D.MnO4,E.H2O2,F.KClO3,G.KMnO4溶液。试回答:
(1)若要快速制备少量氧气,应选择________(填答案标号)。
(2)若要快速制少量HCl,应选择________(填答案标号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com