某化学课外活动小组在实验室做了如下一系列实验:

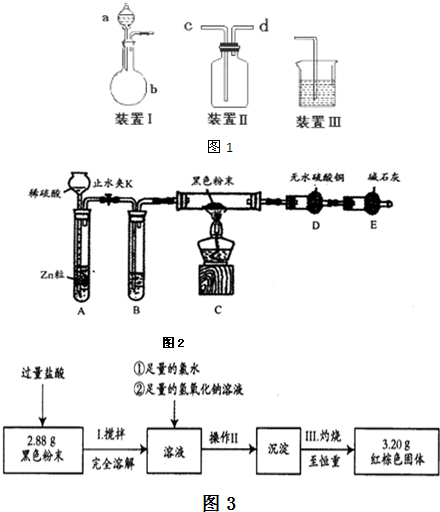
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入
H2O2
H2O2
或
H2O
H2O
,装置Ⅱ从
C
C
管口进气即可作为排气法收集O
2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法
先往集气瓶中装满水,按照图Ⅱ装置好,C导气管接装置Ⅲ后,从D处导气管通入一氧化氮气体排净集气瓶内的水
先往集气瓶中装满水,按照图Ⅱ装置好,C导气管接装置Ⅲ后,从D处导气管通入一氧化氮气体排净集气瓶内的水
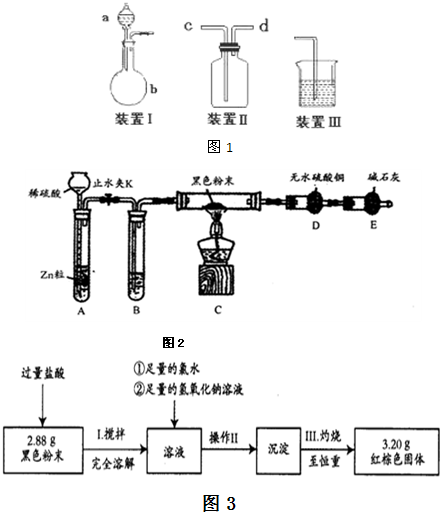
学习小组在研究CH
4还原Fe
2O
3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe
3O
4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
Fe
Fe
,产生气泡的离子方程式为
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.
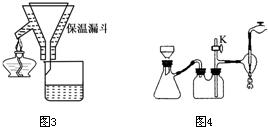
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是
关闭止水夹K,往长颈漏斗加水至漏斗内的液面高于导气管,静置一段时间后液面差保持不变,说明装置A的气密性良好
关闭止水夹K,往长颈漏斗加水至漏斗内的液面高于导气管,静置一段时间后液面差保持不变,说明装置A的气密性良好
.
②B中试剂的名称是_
浓硫酸
浓硫酸
.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是
是
是
(填“是或否”)含有Fe
3O
4.
④综上所述:黑色粉末的组成为
Fe
Fe
和
Fe3O4
Fe3O4
.
(3)为进一步证明黑色粉末是否含Fe
3O
4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:
不可行,因Fe3O4溶于盐酸生成Fe3+与Fe反应生成Fe2+,溶液不变色
不可行,因Fe3O4溶于盐酸生成Fe3+与Fe反应生成Fe2+,溶液不变色
.
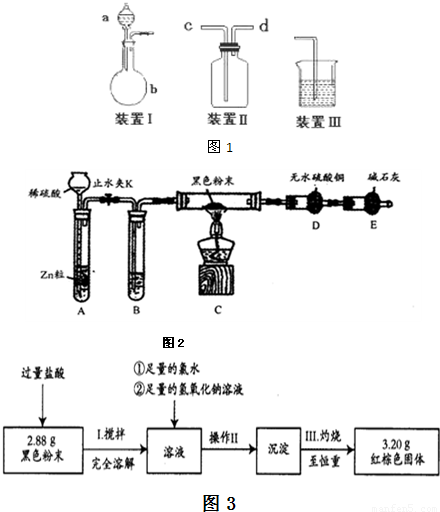
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是
过滤
过滤
、
洗涤
洗涤
、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为
Fe 0.56 Fe3O4 2.32
Fe 0.56 Fe3O4 2.32
.

 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.