甲醇是一种燃料,也可以作为燃料电池的原料.
(1)已知在常温常压下:
①2CH
3OH(l)+3O
2(g)=2CO
2(g)+4H
2O(g)△H
1=-1275.6KJ/mol
②2CO (g)+O
2(g)=2CO
2(g)△H
2=-566.0KJ/mol
③H
2O(g)=H
2O(l)△H
3=-44.0KJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
;
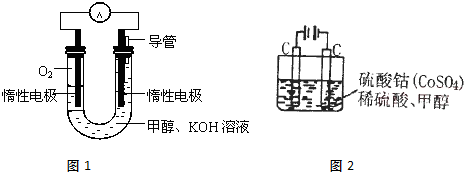
(2)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图1所示的电池装置,则电池正极的电极反应式:
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
,该电池工作时,溶液中的OH
-向
负
负
极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为
2CH3OH+3O2+4OH-=2CO32-+6H2O
2CH3OH+3O2+4OH-=2CO32-+6H2O
;
(3)甲醇对水质会造成一定的污染,用如图2所示的电化学法可消除这种污染,原理是:通电后,将Co
2+氧化成Co
3+,然后以Co
3+做氧化剂再把水中的甲醇氧化成CO
2而净化.则用该装置净化含10mol甲醇的水,转移电子数为
60NA
60NA
.

 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.