
题目列表(包括答案和解析)

| 序 号 |
实验药品 | 实验结论 | ||
| 甲 | 乙 | 丙 | ||
| A | ① | 二氧化锰 | ② | 氧化性:O2>S |
| B | 醋酸溶液 | 碳酸钠溶液 | 硅酸钠溶液 | ③ |
| C | ④ | ⑤ | 氯化铝溶液 | 碱性:NaOH>NH3.H2O>Al(OH)3 |
(18分)实验室常用下列装置制备、收集二氧化氮气体,并探究其性质。
(1)装置A中的分液漏斗里盛装的液体通常是 ,圆底烧瓶中预先加入的是铜片,但铁的价格比铜的价格低,此处用铜片不用铁片的原因是 。
(2)干燥管D中装的干燥剂是无水氯化钙,其作用是 。
(3)随着时间的推移,浓硝酸逐渐变稀,装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下:2NO2+2NaOH=NaNO3+NaNO2+H2O ;NO2+NO+2NaOH=2NaNO2+H2O
①NO和NO2混合气体的组成可表示成NOx,该混合气体通入NaOH溶液被完全吸收时,x的值可以为 (填字母)
| A.1.1 | B.1.2 | C.1.5 | D.1.8 |
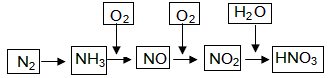
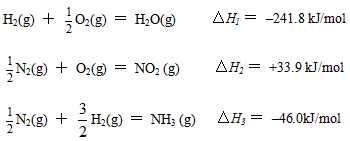
工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应如下图所示:

请回答:
(1)NO2与H2O反应中的还原剂是 。
(2)NH3与O2制取NO的化学反应方程式 。
(3)下列说法不正确的是(选填序号字母) 。
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(4)大量排放含N、P化合物的废水,会导致水体污染。其中含氮的物质主要是蛋白质,蛋白质在水中分解会产生氨气,氨气在微生物的作用下与氧气反应生成HNO2,上述氨气与氧气的反应中,氧化剂与还原剂的物质的量之比为 。
(5)已知:
H2(g) + ![]() O2(g) = H2O(g) △H1 = –241.8 kJ/mol
O2(g) = H2O(g) △H1 = –241.8 kJ/mol
![]() N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
N2(g) + O2(g) = NO2 (g) △H2 = +33.9 kJ/mol
![]() N2(g) +
N2(g) + ![]() H2(g) = NH3 (g) △H3 = –46.0kJ/mol
H2(g) = NH3 (g) △H3 = –46.0kJ/mol
则17g氨气与氧气反应生成NO2(g)与H2O(g)时,△H= kJ/mol。
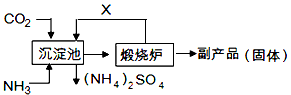
(6)氨气是氮肥工业的重要原料,某化肥厂生产铵态氮肥(NH4) 2SO4的工艺流程如下:
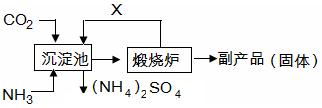
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因是 。

 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解 Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解
 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.液态N2O4电离得到的两种离子所含电子数相差18,Cu与液态N2O4反应制得无水硝酸铜的化学方程式是湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com