(2010?顺义区一模)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质.请回答:
(1)实验室制取氨气的化学方程式是
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
.
(2)①如图(1)是进行氨气喷泉实验的装置,引发喷泉的操作步骤是
轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K
轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K
.
②氨气使烧杯中溶液由无色变为红色,其原因是
NH3+H2O?NH3?H2O?NH4++OH-
NH3+H2O?NH3?H2O?NH4++OH-
(用电离方程式表示).
(3)该小组同学设计了如图(2)所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物.
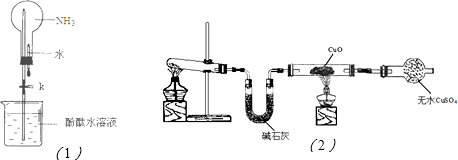
①实验现象为:黑色CuO变为红色;白色无水CuSO
4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式
.
②碱石灰的作用是
吸收氨气中混有的水蒸气,防止干扰产物水的测定
吸收氨气中混有的水蒸气,防止干扰产物水的测定
.
③该装置存在明显缺陷,请指出存在的问题并提出改进意见
此装置无有尾气吸收装置,NH
3排入大气,污染环境;连接一个吸收氨气装置如图所示:

;
此装置无有尾气吸收装置,NH
3排入大气,污染环境;连接一个吸收氨气装置如图所示:

;
.
(4)有同学认为:NH
3与CuO反应生成的红色物质中可能含有Cu
2O.已知:Cu
2O是一种碱性氧化物;在酸性溶液中,Cu
+的稳定性比Cu
2+差(Cu
+ Cu+Cu
2+).请你设计一个简单的实验检验该红色物质中是否含有Cu
2O.
取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O反之则没有
取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O反之则没有
;
(5)工业废气中的氮氧化物是主要的大气污染物之一.为了治理污染,工业上常用氨气与之发生反应:NO
x+NH
3→N
2+H
2O,使其转化为无毒的N
2.现有NO
2和NO的混合气体3.0L,跟3.4L(同温同压下)NH
3反应,恰好使其全部转化为氮气,则原混合气体中,NO
2与NO的体积比是
7:3
7:3
.



 ;
; ;
;