
题目列表(包括答案和解析)
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |

海水中主要离子的含量如下:
|
成分 |
含量/(mg/L) |
成分 |
含量/(mg/L) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Mg2+ |
1272 |
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
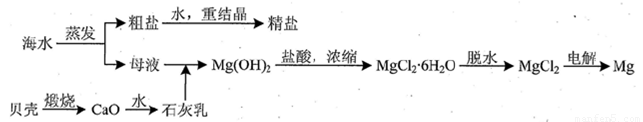
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。

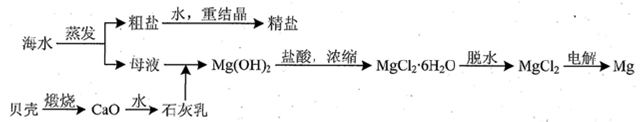
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2•6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。
海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下:
 |
(1) 在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可
放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的
转化,而实际生产中采用300°C的温度,其原因是 。
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循
环利用”的除碳酸钾溶液外,还包括 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。 (填字母代号)
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为 时,参加反应的氧气的体积是6.72L(标准状况下)。
(17分)最近 科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下:
科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇(分子式为CH3OH)。“绿色自由”构想技术流程如下:
(1) 在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是 。
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。 (填字母代号)
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com