
题目列表(包括答案和解析)
![]()
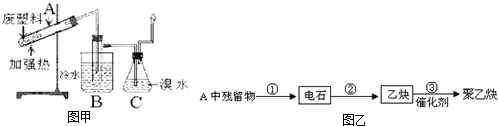
(1)若X具有强氧化性,举两例分别写出对应的A、B、C的化学式(FeS2不能填写)。
例1:A________________,B________________,C________________。 例2:A_____________, B______________,C______________。
(2)若X为较活泼的金属,向C的水溶液中滴加硝酸银溶液有不溶于稀硝酸的白色沉淀析出,则B可能的化学式是_______________。若将铜片和碳棒用导线连接后插入B的水溶液中,构成原电池,写出负极的电极反应式:__________________________________________。
(3)若上述(2)中C溶液保存时需加入少量X,理由是____________________________。
(4)若A是一种常见的无机化合物,请写出反应①的化学方程式:(只要求写一例)
____________________________________________________________________。
(5)某工厂用含FeS260%的硫铁矿通过上述途径制取硫酸。已知反应①中S的损失率为2%,反应②中S的转化率为90%,则100 t硫铁矿可生产98%的浓硫酸__________吨。
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
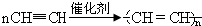
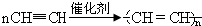
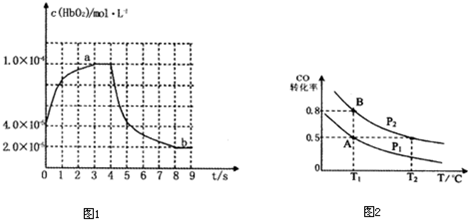
| 1 |
| 10000 |
| 1 |
| 10000 |
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | … |
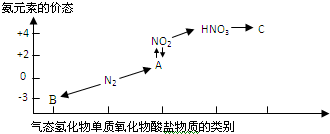 如图是氮元素的几种价态与物质类别的对应关系:
如图是氮元素的几种价态与物质类别的对应关系:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com