
题目列表(包括答案和解析)
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:
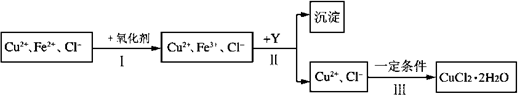
请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为________.
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的________(填字母);
A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是________.
(3)步骤Ⅲ应控制的实验条件是________.
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:
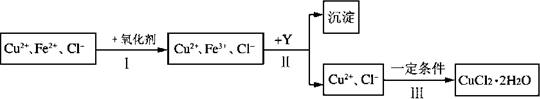
请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为________.
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的________(填字母);
A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是________.
(3)步骤Ⅲ应控制的实验条件是________.
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:

请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为________.
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的________(填字母);
A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是________.
(3)步骤Ⅲ应控制的实验条件是________.
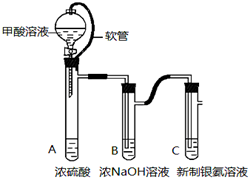 银氨溶液可用于检测CO气体.实验室研究该反应的装置图如图:
银氨溶液可用于检测CO气体.实验室研究该反应的装置图如图:银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述。某同学进行如下研究:
(1)在干净试管中加入2ml2% ,然后, 得到银氨溶液,分装入5支试管,编号为1#.2#.3#.4#.5# 。
(2)依次滴加2%.5%.10%.20%.40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中。3分钟后,试管1#未形成大面积银镜,试管5# 的银镜质量差有黑斑, 试管4# 产生的银镜质量一般,试管2#.3# 形成光亮的银镜。
该研究的目的是: 。
(3)乙醛发生银镜反应的化学方程式为: ,
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜。验证和对比实验如下。
|
装置 |
实验序号 |
试管中的药品 |
现象 |
|
|
实验Ⅰ |
2mL银氨溶液和数滴较浓NaOH溶液 |
有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
|
实验Ⅱ |
2mL银氨溶液和 数滴浓氨水 |
有气泡产生:一段时间后,溶液无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料后,得知:
a.Ag(NH3)2++2H2O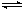 Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。产生Ag2O的原因是:
。
(5)用湿润的红色石蕊试纸检验NH3产生的现象是 。用稀HNO3清 洗试管壁上的Ag,该反应的化学方程式是 。
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O。如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com