
题目列表(包括答案和解析)
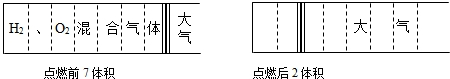
| A、7:2 | B、16:5 | C、2:5 | D、10:11 |
| 3 Li 7 |
Be |
5 B 11 |
6 C 12 |
7 N 14 |
8 O 16 |
9 F 19 |
10 Ne 20 |
| 11 Na 23 |
Mg 24 |
13 Al 27 |
14 Si 28 |
15 P 31 |
16 S 32 |
17 Cl 35.5 |
18 Ar 40 |

| 编 号 | 1 | 2 | 3 |
| 实验前 | 228.00 | 228.00 | 228.00 |
| 实验后 | 229.10 | 229.11 | 229.09 |

| ||
| ||
| 溶质 | CH3COOH | NaHCO3 | Na2CO3 | NaClO | NaCN | NaCl |
| pH | 8.8 | 8.6 | 11.6 | 10.3 | 11.1 | 7 |
已知复分解反应2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑可进行.在常温下,测得相同浓度的下列六种溶液的pH:
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com