
题目列表(包括答案和解析)
| ||
| ||
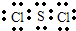
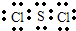
| ||
| ||
| ||
| ||


| ||
| ||
一、选择题:1.D 2.C 3.C 4.D 5.C 6.D 7.A 8.B 9.B 10.A 11. C 12.C 13.A 14.A 15.C 16.D 17.D 18.AC 19.C 20.AD 21.BC
二、非选择题:
22. (1)①为了保证小球每次做平抛运动的初速度相同(2分)。
理综.files/image054.gif)
② ;(3分)。 ③1.00(3分)。
理综.files/image056.gif) (2)①1.00kΩ(2分)。将选择开关打到“×
(2)①1.00kΩ(2分)。将选择开关打到“×
②见右图(3分)(不是分压扣1分) ③大于(2分)
理综.files/image057.gif) 23.解 (1)由万有引力提供向心力
23.解 (1)由万有引力提供向心力
理综.files/image059.gif)
(2)设人在B1位置刚好看见卫星出现在A1位置,最后
在B2位置看到卫星从A2位置消失, OA1=2OB1
有理综.files/image061.gif) ∠A1OB1=∠A2OB2=π/3
∠A1OB1=∠A2OB2=π/3
从B1到B2时间为t
理综.files/image063.gif)
则有
24.解:(1)设物体C与A碰撞前速度为V0,则根据动能定理:
理综.files/image065.gif)
……………………………………………………①(2分)
理综.files/image067.gif) …………………………………………………(2分)
…………………………………………………(2分)
A、C两物体碰撞时间极短动量守恒:理综.files/image069.gif) ……………②(3分)
……………②(3分)
V=
理综.files/image071.gif)
(2)根据F=kx,开始时弹簧压缩量…………(1分)
B刚要离开地面时弹簧伸长量理综.files/image073.gif) ……………(1分)
……………(1分)
则AC一起运动的最高点和碰撞位置的距离为理综.files/image075.gif) ……③(2分)
……③(2分)
设从AC一起运动直至最高点的过程中弹簧弹力做功为W,根据动能定理:
理综.files/image077.gif) …………………………④(3分)
…………………………④(3分)
解①②③④式得W=0.3J ……………………(2分)
25.(20分)解:(1)由图如L=d=
由动能定量:mgS1?sinθ=理综.files/image079.gif) mv
mv理综.files/image081.gif) 由图知S1=
由图知S1=
∴θ=30° (2分)
(2)在磁场中运动时v1=
I=理综.files/image083.gif) (2分)
(2分)
mgsinθ=BIL (2分)
∴B=理综.files/image085.gif) (1分)
(1分)
(3)设线框到达磁场时速度为v2
则(F-mgsinθ)S3=理综.files/image087.gif) (2分)
(2分)
线框进入磁场时,有
F=mgsinθ+理综.files/image089.gif) (2分)
(2分)
∴v2=理综.files/image091.gif) (1分)
(1分)
由于v2<v1,∴线框穿出碰场后F需继续作用一段时间方可保证线框能够到达上端由能量守恒得:W小=mgSsinθ+理综.files/image093.gif) (2分)
(2分)
=0.1×10×3.4×0.5J+理综.files/image095.gif) (2分)
(2分)
26.(共15分)
(1) O Cl (各2分)
理综.files/image096.gif)
理综.files/image097.gif)
理综.files/image096.gif)
(2)① ∶Cl∶S∶Cl∶ ② 分子 (各2分)
(3)H2O2 + 2H+ +2Fe2+ = 2Fe3+ 2H2O (3分)
(4) ① 阴极 ② 0 (各2分)
27.(每空3分,共15分)
(1)SO2 + NH3 + H2O = NH4HSO3
(2)c(NH4+) > c(SO42?) > c(H+) > c(OH?)
(3)0.5 1
(4)D
28.(共15分)
(1)过滤(3分) 蒸发浓缩、冷却结晶后过滤(3分)
(2)连接好装置,从漏斗向量气筒内注入一定量的水,移动漏斗使左、右两侧形成液面高度差。静置后,液面高度不再变化,即表明气密性良好。(其他合理方法均给分)(3分)
(3)移动漏斗保持液面与量气筒液面相平(3分)
(4)理综.files/image099.gif) %(3分)
%(3分)
29.(共15分)
(1)羧基 (2分)
CH3CHO +
2Cu(OH)2 理综.files/image101.gif) CH3COOH
+Cu2O + 2H2O (3分)
CH3COOH
+Cu2O + 2H2O (3分)
(2)C10H10O2 (3分)
理综.files/image102.gif)
理综.files/image103.gif)
理综.files/image104.gif)
理综.files/image105.gif)
30、(1)尿中苯丙酮酸的含量 常染色体隐性 发病率低 无性别差异 会
(2)转氨基作用 脱氨基作用 肝脏 尿素
(3)头发变黄
(4)苯丙氨酸
(5)pp 苯丙酮酸
理综.files/image107.gif) (6)
(6)
31.I(1)上年存储于茎中的物质和能量 有 茎中储能不足
(2)秋季落叶后次年长新叶前 此期树干中储存有较多的营养物质 常绿阔叶树的树干中可能储存的可利用物质少
Ⅱ第一步:取带嫩叶和花蕾的金银花枝条若干,随即分成相等的二组编号甲、乙。
第二步:甲组去全部叶,乙组不去叶,分别置于有适量清水的广口瓶中。
第三步:一同置于有阳光的地方,培养一段时间,观察开花的情况。
预期结果和相应结论:
①甲不开花,乙开花。说明假设成立
②甲开花,乙开花。说明假设不成立
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com