
题目列表(包括答案和解析)

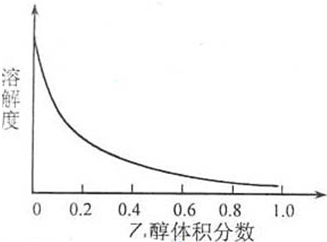
 Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。
Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。
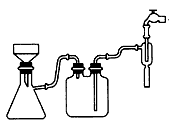
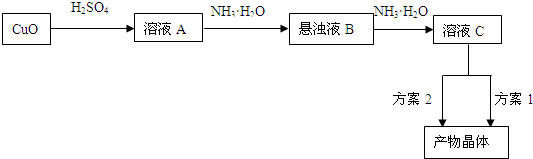

 Cu2++4NH3
Cu2++4NH3



一、1B、2D、3C、4A、5D、6D、7D、8C、9AC、10B、11B、12B、13D、14C、15AD、16C、17C、18D、19CD、
二、20. (1)酸性、难挥发性;(2)酸性(酸的氧化性);(3)酸性、难挥发性;(4)酸性、强氧化性。
21.(1)乙中品红褪成无色;甲中溶液显蓝色。Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O。(2)装置甲试管内溶液变黑色浑浊;装置甲中试管上部有白雾;反应开始时铜片表面变黑并有气泡产生……(3)Na2CO3+SO2=Na2SO3+CO2↑
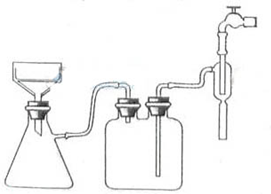
22.(1)反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热后,水会升到导管里形成一段水柱,证明装置不漏气。
(2)2H2SO4(浓)+C 2H2O+2SO2+CO2
2H2O+2SO2+CO2
(3)A:无水硫酸铜。检验水。B:品红溶液。检验二氧化硫。D:澄清石灰水。检验二氧化碳。(4)酸性高锰酸钾溶液的颜色不褪尽。
23. 硫酸钾 硝酸钡 硫酸氢钠 碳酸钾
24. Na2 SO3+SO2 +H2O=2NaHSO3 2NaHSO3====== Na2SO3+ SO2↑+ H2O
25. 甲方案不严密,可能有Ag+干扰;乙方案严密,足量稀盐酸能排除Ag+、CO32-、SO32-的干扰;丙方案不严密,加入的稀硫酸有干扰。
第二部分
26D、27B、28B、
33.2H2SO4+O2+2Cu=2CuSO4+2H2O 2H2SO4(浓)+Cu=CuSO4+ SO2↑+2H2O 前 节省原料 ,无污染
34. (1)2CaSO4?H2O 2CaSO4?H2O+3H2O=2(CaSO4?2H2O) (2) Na2CO3+CaSO4=CaCO3+Na2SO4
35.(1)126b/217 142b/233
126b/217<a<142b/233 (2)
36.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com