
题目列表(包括答案和解析)
新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数(K)表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3![]() HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-![]() CO32-+H+ Ka2(HCO3-)=5.61×10-11
CO32-+H+ Ka2(HCO3-)=5.61×10-11
HClO![]() H++ClO- Ka(HClO)=2.95×10-8
H++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应, 有少量气泡产生,溶液浅黄绿色褪去;
 ②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
①反应后所得的溶液漂白性增强的原因是______ ___________ ____
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有______ _ 。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状 碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
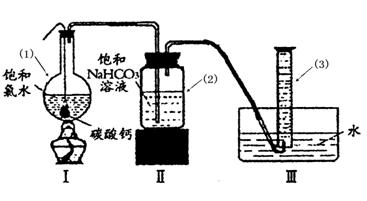
请回答:
③写出仪器(1)与仪器(3)的名称:(1) (3)
④为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
⑤如何准确读出量筒中气体的体积
a.________ _ ________ _ ________ _ ________
b.上下移动量筒至量筒内液面与水槽液面相平
c. ________ _ ________
(15分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数(K)表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+ Ka2(HCO3-)=5.61×10-11
HClOH++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
①反应后所得的溶液漂白性增强的原因是______ ___________ ____
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有______ _ 。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状 碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
请回答:
③写出仪器(1)与仪器(3)的名称:(1) (3)
④为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
⑤如何准确读出量筒中气体的体积
a.________ _ ________ _ ________ _ ________
b.上下移动量筒至量筒内液面与水槽液面相平
c. ________ _ ________
(15分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)氯气能使湿润的红色布条褪色。使其褪色的微粒的化学式是______
(2)将氯水在光照上一段时间,溶液颜色逐渐变浅,其有关反应的化学方程式为:
、
(3)平衡常数(K)表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+ Ka2(HCO3-)=5.61×10-11
CO32-+H+ Ka2(HCO3-)=5.61×10-11
HClO H++ClO- Ka(HClO)=2.95×10-8
H++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,请写出将少量的氯气通入到过量的碳酸钠溶液中所发生反应的离子方程式:
(4)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应, 有少量气泡产生,溶液浅黄绿色褪去;
 ②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
①反应后所得的溶液漂白性增强的原因是______ ___________ ____
②依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有______ _ 。
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状 碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解)。
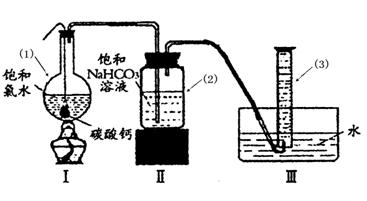
请回答:
③写出仪器(1)与仪器(3)的名称:(1) (3)
④为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是 。
⑤如何准确读出量筒中气体的体积
a.________ _ ________ _ ________ _ ________
b.上下移动量筒至量筒内液面与水槽液面相平
c. ________ _ ________
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究。
实验一:定性研究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色退去;
②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性比氯水强的原因是 。
(2)依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有 (填写溶质的化学式)。
实验二:定量研究。
在圆底烧瓶底部,用一塑料网包住块状石灰石(过量)与150 mL饱和氯水反应,按下图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,将装置密封后再加热,煮沸烧瓶中的液体,量筒中的气体不再增加时停止实验。
请回答:
(3)实验结束后检测到量筒中收集到的气体除CO2外还有O2,请写出Ⅰ中产生O2的化学反应方程式 。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,请你对装置Ⅲ进行改进(水槽中仍为水),最简单的方法是 。
(14分)某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
(1)用下列实验装置制取干燥纯净的氯气
①制备并收集得到干燥纯净的氯气,上述各装置按气流从左到右方向连接顺序为
(填仪器接口的字母编号)
②该实验还存在不足之处,应如何改进?
(2)某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质a,然后通过实验确定其成分。探究过程如下:
①提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl3;假设②: ;假设③: 。
②设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空。
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | | 固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含______ |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com