
题目列表(包括答案和解析)
(12分)下面是某化学研究性学习小组对某水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Ca2+、Cl-、CO和SO中的若干种,该小组同学取100 mL水样进行实验:
向样品中先滴加BaCl2溶液,再滴加1.0 mol·L-1的盐酸,实验过程中沉淀质量的变化如右图所示:
请回答下列问题:
(1)水样中一定含有的阴离子是________________,其物质的量之比为________。
(2)写出BC段曲线所表示反应的离子方程式________________。
(3)由B点到C点变化过程中消耗盐酸的体积为________。
(4)试根据实验结果推测K+是否存在?________(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是________。(若K+不存在,则不必回答该问)
(14分)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。甲+乙丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水。
① 若甲为块状固体,丙为可燃性气体,其分子内既含有极性键又含有非极性键。则丙的电子式是 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 。
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水。
① 若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是 。
② 若丙和丁都可在一定条件下还原,此反应的化学方程式是 。
③ 若甲是由N和O元素组成的气态物质,呈红棕色。将3.36 g加到一定量丙溶液中,收集到1.12 L气体丁(已折算为标准状况),则反应的离子方程式是 。
(3)Hofmann依据上述转化关系测定氨分子的组成。现用如右图所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至处。
① 滴下浓氨水一段时间后,试管内发生反应的化学方程式是 。
② 证明试管内“不再反应”的实验操作和现象是 。
(12分)下面是某化学研究性学习小组对某水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Ca2+、Cl-、CO和SO中的若干种,该小组同学取100 mL水样进行实验:
向样品中先滴加BaCl2溶液,再滴加1.0 mol·L-1的盐酸,实验过程中沉淀质量的变化如右图所示:
请回答下列问题:
(1)水样中一定含有的阴离子是________________,其物质的量之比为________。
(2)写出BC段曲线所表示反应的离子方程式________________。
(3)由B点到C点变化过程中消耗盐酸的体积为________。
(4)试根据实验结果推测K+是否存在?________(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是________。(若K+不存在,则不必回答该问)
(共12分)钛是21世纪金属。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
TiO2+发生水解的离子方程式为 。
(2)反应I在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ;
反应II的热化学方程式为 。
(3)该工艺流程中,可以循环使用的物质有 (填化学式)。
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 极,阴极的电极反应式为 。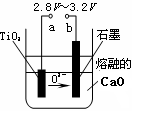
(16分)
(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用_(填“氧化剂”或“还原剂”)与之反应。
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法: 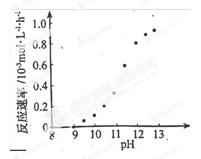
(3)酸浸法制取硫酸铜的流程示意图如下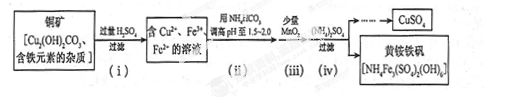
① 步骤(i)中Cu2(OH) 2CO3发生反应的化学方程式为 。
② 步骤(ii)所加试剂起调节pH 作用的离子是 (填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为 。
④ 步骤(iv)除去杂质的化学方程式可表示为
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +
过滤后母液的pH =" 2.0" , c (Fe3+) ="a" mol·L-1,, c ( NH4+)="b" mol·L-1,, c ( SO42-)=" d" mol·L-1,该反应的平衡常数K=_ (用含a 、b 、d 的代数式表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com