
题目列表(包括答案和解析)
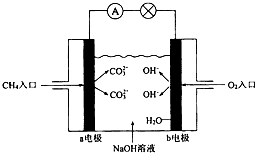 I.Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
I.Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.(1)下列关于天然气水合物中两种分子极性的描述正确的是( )
A.两种都是极性分子 B.两种都是非极性分子
C.CH4是极性分子,H2O是非极性分子 D.H2O是极性分子,CH4是非极性分子
(2)如晶体中每8个笼只有6个笼容纳了CH4分子,另外2个笼被游离H2O分子填满,则天然气水合物的平均组成可表示为( )
A.CH4·14H2O B.CH4·8H2O C.CH4·7![]() H2O D.CH4·6H2O
H2O D.CH4·6H2O
一种甲烷水合物晶体中,平均每46个分子构成8个水分子笼,每个水分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,这种可燃冰的平均分子组成是
A、CH4·5H2O B、CH4·6H2O C、CH4·7H2O D、CH4·8H2O
第28届国际地质大会提供的资料显示,海底有大量的天然气水合物。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。若晶体中每8个笼只有6个容纳了CH4分子,另外两个笼被游离的H2O分子填充,则天然气水合物的平均组成可表示为……( )
A、CH4·14H2O B、CH4·8H2O C、CH4·7H2O D、CH4·6H2O
“温室效应” 是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)下列措施中,有利于降低大气中CO2浓度的有 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
![]()
![]() a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
a.6CO2+6H2O C6H12O6+6O2 b.CO2+3H2 CH3OH+H2O
![]()
![]() c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
c.CO2+CH4 CH3COOH d.2CO2+6H2 CH2=CH2+4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即:
![]()
![]() CO2 HCOOH CH4
CO2 HCOOH CH4
①写出产生H2的反应方程式 。
 ②由图可知,镍粉是 。(填字母)
②由图可知,镍粉是 。(填字母)
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂
d.不是催化剂![]()
![]()
![]()
![]()
![]()
![]()
![]()
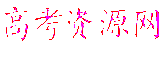
③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率
均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
一、1.C 2.A 3.C?
4.解析:比较物质熔、沸点高低时,首先判断晶体类型。一般是,原子晶体>离子晶体>分子晶体;然后比较同一类型晶体中,粒子间的作用力。共价键比键长,离子键看离子半径和电荷数,分子间作用力主要比分子量的大小。(注意氢键的存在)?
答案:B?
5.D 6.D 7.B?
8.解析:每一个环内电子数为3×5+3×7=36,与石墨层中一个环内电子数6×6=36是相同的,故与石墨为“等电子体”,性质类似石墨。?
答案:B?
9.解析:每个碳原子为三个六元环所共有,则每个正六边形所占有的碳原子数为6× =
=
2个。
答案:D?
10.D 11.B?
二、12.6 109°28′ 2 W??

2Na2O2+2H2O===4NaOH+O2↑?
(5)离子 S2-+H2O HS-+OH- HS-+H2O
HS-+OH- HS-+H2O H2S+OH-?
H2S+OH-?
16.(1)密度= g?cm-3?
g?cm-3?
(2)6∶91
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com