
题目列表(包括答案和解析)
向硝酸钠溶液中加入铜粉不发生反应,若再加入(或通入)某种物质,则铜粉可以逐渐溶解,不符合此条件的物质是
| A.Fe(NO3)3 | B.HCl | C.NaHSO4 | D.NaHCO3 |
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
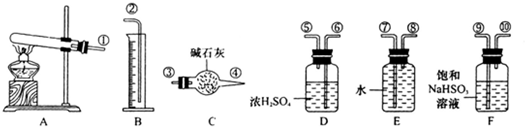
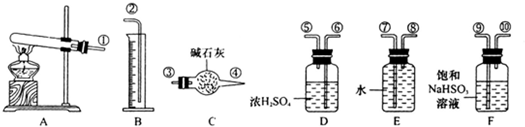
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |
| 氧气 |
| △ |
| 稀H2SO4 |
| 硫酸亚铁 |
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
| 浓H2SO4 |
| △ |
| △ |
| 氧气 |
| △ |
| 稀H2SO4 |
| 硫酸亚铁 |
| 硝酸银 |
| 氢氧化钠 |
| 稀硫酸 |
| 浓H2SO4 |
| △ |
| △ |
| ||
| ||
| ||
| △ |
| ||
| △ |
| 硝酸银 |
| 氢氧化钠 |
| 稀H2SO4 |
| ||
| △ |
| ||

| ||
| ||
1
2
3
4
5
6
7
8
AD
B
B
A
C
B
C
C
9
10
11
12
13
14
15
16
C
B
B
CD
D
A
C
BD
练习二
%20无机物的推断.files/image071.gif) 1、⑴ A、Na2SO3 B、BaCl2
1、⑴ A、Na2SO3 B、BaCl2
⑵ ①2Cl- + 2H2O 2OH- + Cl2↑ + H2↑
%20无机物的推断.files/image072.gif) ②BaSO3
+ Cl2 + H2O
BaSO4↓ +2H+ + 2Cl-
②BaSO3
+ Cl2 + H2O
BaSO4↓ +2H+ + 2Cl-
%20无机物的推断.files/image073.gif) ③SO2
+Cl2 + 2H2O
4H+ + 2Cl- + SO42-
③SO2
+Cl2 + 2H2O
4H+ + 2Cl- + SO42-
%20无机物的推断.files/image074.gif) 2、① CaC2 ② Ca2+
+CO32- CaCO3↓
2、① CaC2 ② Ca2+
+CO32- CaCO3↓
%20无机物的推断.files/image075.gif) ③ 2CO2
+ Ca(OH)2 Ca2+
+ 2HCO3-
③ 2CO2
+ Ca(OH)2 Ca2+
+ 2HCO3-
④ 5:1
3、① ClO- ② H+、Cl- ③ 4:5
%20无机物的推断.files/image076.gif) 4、①(NH4)2S O2 H2O
4、①(NH4)2S O2 H2O
② HNO3 NH4+ + OH- NH3↑ + H2O
%20无机物的推断.files/image074.gif) ③ H2SO4 S2- + 2H+ 2H2S↑
③ H2SO4 S2- + 2H+ 2H2S↑
5、① CO2、SO2、SO3、P2O5等中的任意两种
%20无机物的推断.files/image077.gif) S2- + 2H+ 2H2S↑
Al(OH)3 NaAlO2
S2- + 2H+ 2H2S↑
Al(OH)3 NaAlO2
② Y>X>Z 或 Z>X>Y
6、① NaOH ② NaAlO2 、 Ca(OH)2 ③ Mg(OH)2 ④CO2 ⑤Ca(HCO3)2
⑥Al(OH)3 ⑦ HCl
%20无机物的推断.files/image078.gif)
%20无机物的推断.files/image079.gif)
%20无机物的推断.files/image080.gif)
%20无机物的推断.files/image075.gif) 7、⑴① FeO + 2HCl FeCl2
+ H2O CuO + 2HCl CuCl2
+ H2O② 2FeO + C
7、⑴① FeO + 2HCl FeCl2
+ H2O CuO + 2HCl CuCl2
+ H2O② 2FeO + C %20无机物的推断.files/image081.gif) 2Fe
+ CO2
2CuO + C
Cu + CO2
2Fe
+ CO2
2CuO + C
Cu + CO2
%20无机物的推断.files/image082.gif)
%20无机物的推断.files/image083.gif) ③ Fe + CuCl2 FeCl2
+ Cu Fe +
2HCl
FeCl2 + H2↑
③ Fe + CuCl2 FeCl2
+ Cu Fe +
2HCl
FeCl2 + H2↑
⑵ m(x)=56g m(FeO):m(CuO)=9:5
%20无机物的推断.files/image085.gif)
%20无机物的推断.files/image086.gif)
%20无机物的推断.files/image074.gif) 8、① ② Na2SO3
+ H2SO4 Na2SO4
+ SO2↑ + H2O
8、① ② Na2SO3
+ H2SO4 Na2SO4
+ SO2↑ + H2O
③ 4FeS + 11O2 2Fe2O3 + 8SO2
④现在样品中加入足量的稀HCl,再加BaCl2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com