
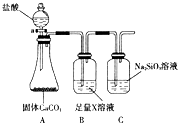
题目列表(包括答案和解析)
 ①~⑧是元素周期表中的部分元素.
①~⑧是元素周期表中的部分元素.| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||







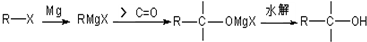
 )用于医药中间体,也用于有机合成.请结合所学有机知识并利用提示信息设计合理方案并完成以对氯甲苯和甲醇为原料合成对甲氧基苯甲酸甲酯的合成(用合成路线流程图表示,并注明反应条件).
)用于医药中间体,也用于有机合成.请结合所学有机知识并利用提示信息设计合理方案并完成以对氯甲苯和甲醇为原料合成对甲氧基苯甲酸甲酯的合成(用合成路线流程图表示,并注明反应条件). ,
, 高温下易脱去羧基.
高温下易脱去羧基.
| 浓H2SO4 |
| 170℃ |
| Br2 |

| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |



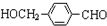 合成高分子化合物
合成高分子化合物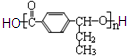 合成反应流程图表示方法示例如下:
合成反应流程图表示方法示例如下: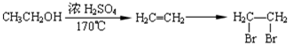

一、1.解析:Fe Fe2+
Fe2+ Fe3+
Fe3+ Fe(OH)3
Fe(OH)3 Fe2O3。
Fe2O3。
答案:A?
2.B 3.C?
4.解析:根据2Fe3++Fe===3Fe2+知,消耗1 mol Fe生成3 mol Fe2+,还消耗2 mol Fe3+。
答案:C?
5.C 6.A 7.B 8.A 9.C 10.AD?
二、11.Fe2O3 CO和H2 Fe3O4、FeO?
12.(1)白色沉淀 灰绿色
灰绿色 红褐色沉淀?
红褐色沉淀?
(2)3Fe+2NO +8H+===3Fe2++2NO↑+4H2O?
+8H+===3Fe2++2NO↑+4H2O?
(3)由反应2HNO3+NO===3NO2+H2O知,在浓HNO3中不可能生成NO?
13.(1)Fe Cl2 H2?
(2)2Fe+3Cl2 2FeCl3
2FeCl3
(3)2HCl+Fe===FeCl2+H2↑?
(4)2FeCl2+Cl2===2FeCl3?
14.(1)Fe FeCl3 FeCl2 Fe(OH)3 Fe2O3 (2)略?
15.65 g 20.5%?
16.(1)ac?
(2)设Fe2O3原有n0 mol,还原百分率为A%,则有?


A%= ≈33.3%
≈33.3%
(3)3-
(4)Fe2O3、Fe3O4 8<a<9?
Fe3O4、FeO 6<a<8?
Fe2O3、Fe3O4、FeO 6<a<9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com