
题目列表(包括答案和解析)
(07年高考全国理综卷I?26)W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素是________;Z元素是_________。
(2)化合物WY和WX2的化学式分别是__________和___________。
(3)Y和Z形成的两种常见化合物的分子式是_________和_________。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式______________________。
(2002年全国理综卷)如下图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原为D(C6H14O6)。B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。

已知,相关物质被氧化的难易次序是:
RCHO最易,R―CH2OH次之,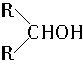 最难。
最难。
请在下列空格中填写A、B、C、D、E、F的结构简式:
A_________、B_________、C__________、D_________、E_________、F_________。
(07年高考理综天津卷?26)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为______________;XW的电子式为__________________;Z元素在周期表中的位置是_________。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)________________。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)__________;V、W的氢化物分子结合H+能力较强的是(写化学式)__________,用一个离子方程式加以证明___________________________________。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________。
由此可知VW和YW2还原性较强的是(写化学式)____________。
(07年高考理综重庆卷?29) (14分)a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2:3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是__________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)__________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为__________________,Z的晶体类型为_____________;ab-离子的电子式为____________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为__________________、___________________。
(07年高考理综天津卷?7)2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期是
A.钅仑 第七周期 B.镭 第七周期
C.铼 第六周期 D.氡 第六周期
一、1.D 2.B?
3.解析:本题结合原电池原理考查实验现象。Fe作负极:Fe-2e-===Fe2+,C作正极:2H2O+O2+4e-===4OH-。
答案:B?
4.解析:本题要设计成原电池必须满足:①Fe作负极;②C、Pt或活动性比Fe弱的金属作正极;③电解质溶液中必须含Fe3+。
答案:CD?
5.C 6.D?
7.解析:正极反应MnO2+e-===MnO 。则n(MnO2)=n(e-)=
。则n(MnO2)=n(e-)=
答案:C?
8.BD 9.B?
二、10.(1)D (2)加CuSO4溶液后,构成Fe―Ag原电池,Fe溶解,质量减小;
Cu2+在银圈上得电子,沉积在Ag上,质量增加?
11.2CO2+O2+4e- 2CO
2CO 2CO+O2
2CO+O2 2CO2
2CO2
12.(1)H2 O2 2H2+4OH--4e-===4H2O?
O2+2H2O+4e-===4OH-?
(2)2H2-4e-===4H+ O2+4H++4e-===2H2O?
前者的pH变小,后者的pH变大。?
(3)CH4+10OH--8e-===CO +7H2O?
+7H2O?
4H2O+2O2+8e-===8OH-?
13.(1)反应速率可以用反应的消耗速率,也可以用产物的生成速率来表示?
(2)直线(y=0.05at)
抛物线(y′=bt )
)
(3)Ni 它的腐蚀速率随时间增长比镁慢?
14.(1)化学 电 离子 ①②③④?
(2)电解质 大 零?
(3)①二 ⅠA ②镉 负?
15.(1)Cu2++2H2O Cu(OH)2+2H+
Cu(OH)2+2H+
(2)因为Cu2++2e-===Cu,使Cu2+水解平衡向左移动,c(H+)减少,pH上升。
(3)pH降低 测定溶液pH?
(4)同意实验派观点;理由是CuCl2===Cu+Cl2↑
Cl2+H2O===HCl+HClO,使溶液酸性增强,pH降低。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com