
题目列表(包括答案和解析)
| O | 2- 4 |
| ||
| ||

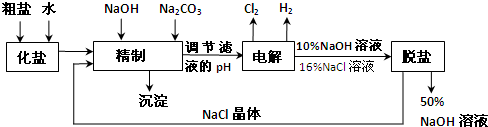
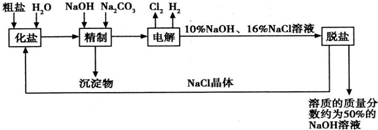
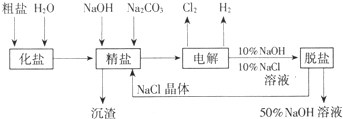 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图: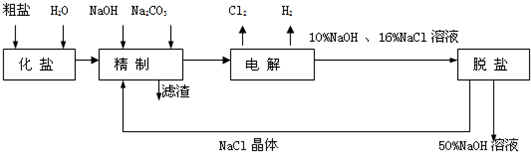
一、1.D?
2.解析:Cl2被完全吸收,Cl2应在下部生成,推知b为正极,a为负极。?
答案:B?
3.C 4.CD 5.B 6.A 7.A 8.BD 9.A?
二、10.(1)Fe Fe-2e-===Fe2+ (2)BC?
(3)隔离空气,防止生成的Fe(OH)2被氧化 加热c,以除去溶解的O2?
(4)BC?
(5)白色沉淀迅速变成灰绿色,最后变成红褐色?
11.(1)有红色物质析出为负极 (2)铜导线变粗为负极?
12.(1)2Cl--2e-===Cl2↑ 升高?
(2)Ca2++CO ===CaCO3↓?
===CaCO3↓?
Mg2++2OH-===Mg(OH)2↓?
(3)AC (4)BC (5)蒸发 过滤?
(6)NaCl+H2O NaClO+H2↑(或2NaCl+2H2O
NaClO+H2↑(或2NaCl+2H2O 2NaOH+H2↑+Cl2↑?
2NaOH+H2↑+Cl2↑?
Cl2+2NaOH===NaCl+NaClO+H2O)?
13.(1)B (2)C?
(3)5KI+KIO3+6HCl===6KCl+3I2+3H2O 5∶1 溶液变蓝?
(4)阳极:I-+3H2O-6e-===IO-3+6H+?
阴极:6H2O+6e-===3H2↑+6OH-?
(5)0.837?
14.T介于
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com