
题目列表(包括答案和解析)
(12分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
![]() (1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”) 。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”) 。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应:
![]() 2 N2O5(g) 4NO2(g)+O2(g) △H>0
2 N2O5(g) 4NO2(g)+O2(g) △H>0
①下表为反应T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为 。
②在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填
“>”“<”“=”)
(3)已知肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水。
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
②用电离方程式表示肼的水溶液呈碱性的原因
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(1)+2H2O2(1)==N2(g)+4H2O(g) △H= —642.2kJ·mol-1
因此肼可以作为火箭推进剂。根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼 。说明原因 。
(12分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。 (1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用 催化剂后反应的△H(填“增大”“减小”或“不改变”) 。
催化剂后反应的△H(填“增大”“减小”或“不改变”) 。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应: 2 N2O5(g) 4NO2(g)+O2(g) △H>0
2 N2O5(g) 4NO2(g)+O2(g) △H>0
①下表为反应T1温度下的部分实验数据:
| t/s | 0 | 500[来源:学|科|网] | 1000 |
| C(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
 N2O5的分解速率为 。
N2O5的分解速率为 。 氧气中燃烧生成氮气和水。
氧气中燃烧生成氮气和水。(12分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应N2(g)+3H2(g)
2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡
移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”)
。
(1)合成氨反应N2(g)+3H2(g)
2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡
移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”)
。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应:
 2 N2O5(g)
4NO2(g)+O2(g) △H>0
2 N2O5(g)
4NO2(g)+O2(g) △H>0
①下表为反应T1温度下的部分实验数据:
|
t/s |
0 |
500[来源:学|科|网] |
1000 |
|
C(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为 。
②在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填
“>”“<”“=” )
(3)已知肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水。
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
②用电离方程式表示肼的水溶液呈碱性的原因
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(1)+2H2O2(1)==N2(g)+4H2O(g) △H= —642.2kJ·mol-1
因此肼可以作为火箭推进剂。根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼 。说明原因 。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
![]() (1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”) 。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”) 。
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应:
![]() 2 N2O5(g) 4NO2(g)+O2(g) △H>0
2 N2O5(g) 4NO2(g)+O2(g) △H>0
①下表为反应T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为 。
②在T2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2 T1(填
“>”“<”“=” )
(3)已知肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水。
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
②用电离方程式表示肼的水溶液呈碱性的原因
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(1)+2H2O2(1)==N2(g)+4H2O(g) △H= —642.2kJ·mol-1
因此肼可以作为火箭推进剂。根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼 。说明原因 。
| 1.将铝片放入饱和氯化铜溶液中,反应较快,浸在溶液中的铝片表面迅速生成蓬松的红色固体,同时在液面处的铝片以及有液体飞溅到上部的铝片表面有黑色物质生成.2.有大量气泡产生,在一段时间内产生气泡越来越快,将其收集并点燃发出爆鸣声.3.有少量蓝色悬浊液产生. |
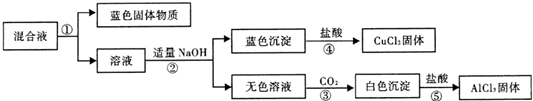
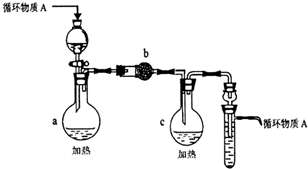
| 预设验证方法 | 猜想的现象 | 结论 |
| 取适量覆盖有黑色物质的铝片于试管中, |
黑色物质含铜,可能是纳米铜 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com