
题目列表(包括答案和解析)
某学生做中和滴定实验的过程如下:a.取一支碱式滴定管;b.用蒸馏水洗净;c.即加入待测的NaOH溶液;d.记录液面刻度读数;e.用酸式滴定管精确放出一定量标准溶液;f.置于未经标准酸液润洗的洁净锥形瓶中;g.加入适量蒸馏水;h.加入酚酞试液2滴;i.滴定时,边滴边振荡;j.边注视滴定管内液面的变化;k.当小心滴到溶液由无色变成粉红色时,即停止滴定;l.记录液面刻度线读数;m.根据滴定管的两次读数得出NaOH溶液体积为25mL。指出上述实验过程中的错误之处_______________(用编号表示)。
| 名称 | 性质 |
| 乙二醇 | 无色粘稠吸湿液体,易燃,沸点:196~198℃,与水混溶. |
| 丙酮 | 无色易燃液体,沸点:56.5℃,溶于水及大多数有机溶剂. |
| N,N二甲基甲酰胺(DMF) | 易燃,低毒,沸点:153℃,能与水和大多数有机溶剂混溶. |
| 对苯二甲酸(TPA) | 白色针状结晶或粉末,可燃,熔点:425℃(分解),约在300℃升华,不溶于水,微溶于热乙醇,溶于碱溶液.电离常数:Ka1=3.1×10-4,Ka2=1.5×10-5 |
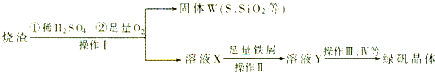
- 4 |
I.铁是人体必须的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成份。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是 ;实验室在配制FeSO4溶液时常加入 以防止其被氧化,请你设计一个实验证明FeSO4溶液是否被氧化 。
(2)测定绿矾样品含量的实验步骤:
a. 称取5.7g样品,溶解,配成250mL溶液
b.量取25mL待测溶液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40mL
根据以上步骤回答下列问题:
①用硫酸酸化的KMnO4滴定终点的标志是 。
②计算上述产品中FeSO4·7H2O的质量分数为 。
II.硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(3)硫酸亚铁铵不易被氧化的原因 。
(4)为检验分解产物的成份,设计如下实验装置进行实验,加热A中硫酸亚铁铵至分解完全。
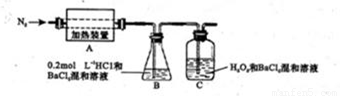
①A中固体充分加热较长时间后,通入氮气,目的是 。
②装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的观象为 。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com