
题目列表(包括答案和解析)
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
|
化学键 |
C—C |
C—H |
C一O |
Si—Si |
Si—H |
Si一O |
|
键能/(kJ·mol-1) |
356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
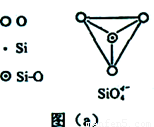
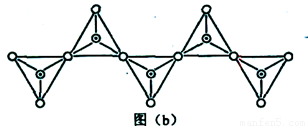
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 。Si与O的原子数之比为 。
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是_________________________________________;
31Ga的第一电离能却明显低于30Zn,原因是______________________________________;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为________________。NH3 分子中N原子的杂化方式为_______杂化,NH3分子的空间立体构型是____________。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是:__________________________________________(用相关的离子方程式和简单的文字说明加以解释)
(3)如图甲所示为二维平面晶体示意图,所表示的化学式为AX3的是________。
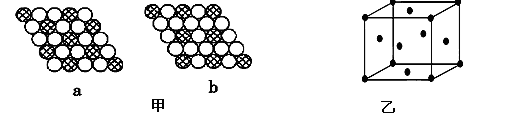
(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度
为ρ g/cm3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
X、Y、Z、W四种物质之间有转化关系如题8图所示(反应条件略),下列有关X、Y的说法错误的是
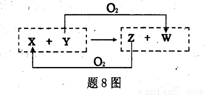
A.X为H2O,Y为F2
B.x为SiO2,Y为c
C.x为CO2,Y为Mg
D.x为H2O,Y为 C.
 2HI(g),实验测得起始及平衡时的有关数据如表所示:
2HI(g),实验测得起始及平衡时的有关数据如表所示: 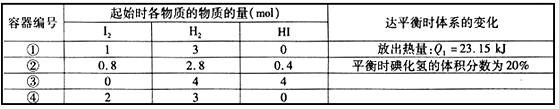
 2HI(g) △H=-23.15kJ/mol
2HI(g) △H=-23.15kJ/mol X、Y、Z、W四种物质之间有转化关系如题8图所示(反应条件略),下列有关X、Y的说法错误的是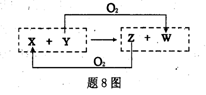
A.X为H2O,Y为F2
B.x为SiO2,Y为c
C.x为CO2,Y为Mg
D.x为H2O,Y为 C.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com