
题目列表(包括答案和解析)
| A、乙酸乙酯在水中的溶解度比乙醇在水中的溶解度大 | B、异丁烷的沸点比正丁烷的沸点高 | C、苯酚的酸性比CH3COOH的酸性强 | D、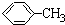 比 比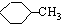 更易被KMnO4酸性溶液氧化 更易被KMnO4酸性溶液氧化 |
 (2010?浙江)已知:
(2010?浙江)已知:
| c(H+)?c(F-) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
1 |
分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是①④溶液 | 略 |
2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式: C6H5OH+NaOH→C6H5ONa+H2O C6H5OH+NaOH→C6H5ONa+H2O |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的酸性 |
略 |
CH3COOH溶液的酸性远大于H2CO3溶液 |
4 |
将CO2通入C6H5ONa溶液中 | 产生白色浑浊 产生白色浑浊 |
反应的化学方程式: C6H5ONa+CO2+H2O=C6H5OH+NaHCO3 C6H5ONa+CO2+H2O=C6H5OH+NaHCO3 |
| 结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号) 乙酸>碳酸>苯酚 乙酸>碳酸>苯酚 | |||

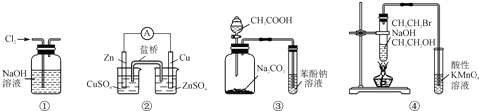
| A、装置①:除去Cl2中含有的少量HCl | B、装置②:构成锌-铜原电池 | C、装置③:根据实验现象推知酸性:CH3COOH>H2CO3>C6H5OH | D、装置④:验证溴乙烷发生消去反应生成烯烃 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com