
题目列表(包括答案和解析)
【选修3物质结构与性质】(15分)
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 ;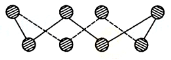
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离
子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型
为 ,SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,
K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
;
② H2SeO4比 H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm.密度为 (列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为 pm(列示表示)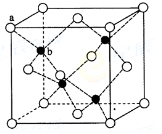
下列有关物质性质、结构的表述均正确,且存在因果关系的是
|
| 表述Ⅰ | 表述Ⅱ |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比SnH4分子稳定性大 | Sn的原子半径比C的大,Sn与H之间的键能比C与H间的键能小 |
| C | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同
|
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物
|
【解析】NaCl和I2形成的晶体分别是离子晶体和分子晶体,在水中的溶解度与化学键无关。CH4分子和SnH4分子中化学键强弱不同,从而导致二者的稳定性不同,B是正确的。在第 ⅦA中F没有正价,O没有最高正价,所以C不正确。溶于水后能否导电,关键是能否电离出阴阳离子,与化合物类型无关,D不正确。答案选B。
下列有关物质性质、结构的表述均正确,且存在因果关系的是
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比SnH4分子稳定性大 |
Sn的原子半径比C的大,Sn与H之间的键能比C与H间的键能小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同
|
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物
|
【解析】NaCl和I2形成的晶体分别是离子晶体和分子晶体,在水中的溶解度与化学键无关。CH4分子和SnH4分子中化学键强弱不同,从而导致二者的稳定性不同,B是正确的。在第 ⅦA中F没有正价,O没有最高正价,所以C不正确。溶于水后能否导电,关键是能否电离出阴阳离子,与化合物类型无关,D不正确。答案选B。
下图是部分短周期元素的常见化合价与原子序数的关系图:

(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 其所含化学键类型为 。
(3)C2-、D+、G2-离子半径大小顺序是 > > (用离子符号回答)
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
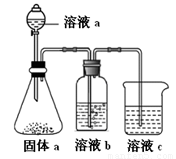
① 溶液a和b分别为 , 。
② 溶液c中的离子方程式为 。
③ 请从原子结构的角度解释非金属性B > A的原因 。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 转移电子的物质的量为 。
② 用一个离子方程式表示该反应 。
下图是部分短周期元素的常见化合价与原子序数的关系图:
(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 ,其所含化学键类型为 。
(3)C2—、D+、G2—离子半径由大到小顺序是 (用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为 , 。
②溶液c中的离子方程式为 。
③请从原子结构的角度解释非金属性B>A的原因 。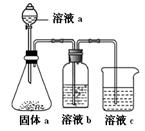
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中:
①转移电子的物质的量为 。
②用一个离子方程式表示该反应 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com