
题目列表(包括答案和解析)
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__ →__CO2↑+ __K2SO4 + __Cr2(SO4)3+__H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是 _______;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知: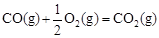 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
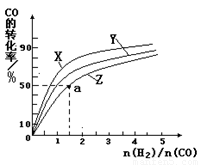
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)  CH3OH(g)的平衡常数K =
。
CH3OH(g)的平衡常数K =
。
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__ →__CO2↑+ __K2SO4 + __Cr2(SO4)3+__H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是 _______;
| A.随时将CH3OH与反应混合物分离 | B.降低反应温度 |
| C.增大体系压强 | D.使用高效催化剂 |
 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
 CH3OH(g)的平衡常数K = 。
CH3OH(g)的平衡常数K = 。说到气体摩尔体积,不能忽视阿伏加德罗定律.为了测定某气体(丁烷,并含少量丙烷等气态烃)样品的平均相对分子质量,某学生设计了如下实验:
①取一个洁净、干燥并配有合适胶塞的锥形瓶,准确称量,得到质量m1;
②向锥形瓶中通入干燥的该气体样品,塞好胶塞,准确称量,重复操作,直到前后两次称量的结果基本相同,得到质量m2;
③向锥形瓶内加满水,塞好胶塞,称量得到质量m3.
[温度:T(K),压强:p(kPa),水的密度:ρ水(g/L),空气的平均式量:29.0,空气的密度ρ空气(g/L)]
请你依据该同学的操作回答下列问题:
(1)步骤②中重复操作的原因是________;
(2)简述在此实验中,如何做到每次测量都是在相同的体积下进行:________;
(3)锥形瓶内空气的质量(m空气)是________(列出算式,下同);
(4)瓶中样品气的质量(m样品)是________;
(5)由实验测得样品气的平均相对分子质量是________;
(6)通过本实验,你得出的结论是________(写一条即可).
摩尔质量和气体摩尔体积
1.摩尔质量
单位物质的量的物质所具有的质量叫做摩尔质量(符号M).准确理解摩尔质量的概念,须注意以下几点:
(1)单位:SI中,摩尔质量的单位是kg·mol-1,中学阶段常用________,此外,还有kg·kmol-1,mg·mmol-1等,其中:1 g·mol-1=1 kg·kmol-1=1 mg·mmol-1.
(2)符号:摩尔质量的符号是M,如氧气的摩尔质量可表示为________.
(3)数值:当摩尔质量以g·mol-1为单位时:
M=Mr g·mol-1或M=Ar g·mol-1,
即它们的纯数值是相等的.
(4)由摩尔质量的概念,得到下列公式:n=![]()
2.气体摩尔体积
在一定的温度和压强下,单位物质的量气体所占的体积叫做气体摩尔体积(符号Vm).
标准状况下,气体的摩尔体积(Vm,0)约为22.4 L·mol-1.
注意:(1)气体摩尔体积不是“体积”,单位不是体积单位L、m3等,其常用单位为:L·mol-1,其SI单位为m3·mol-1.
(2)从气体摩尔体积的概念可抽象气体摩尔体积的公式.即Vm=![]() (或n=
(或n=![]() )
)
(3)概念中“单位物质的量”可以是1 mol,也可以是1 mmol或1 kmol等.
3.影响物质体积的因素
(1)物质所含粒子数的多少.物质所含粒子数________,________越大.
(2)物质所含粒子的________.
(3)物质内粒子间的________.
对固体和液体物质来说,(1)(2)起主要作用;对气体物质来说,(1)(3)起主要作用.
4.阿伏加德罗定律
在相同的温度和压强下,________,这个定律叫做阿伏加德罗定律.
准确理解阿伏加德罗定律要注意以下几点:
(1)使用范围:阿伏加德罗定律的使用范围是________物质,可以是单一气体,也可是混合气体.
(2)表述方式:阿伏加德罗定律的特征是“四同”——同温、同压、同体积、同分子数,其中三个量相同,第四个量必然相同.即阿伏加德罗定律可以有四种表述方式:
①当T、p、N(或n)相同时,V必相同.
②当T、p、V相同时,N(或n)必相同.
③当T、V、N(或n)相同时,p必相同.
④当p、N(或n)、V相同时,T必相同.
下列两种气体的分子数一定相等的是( )
A.质量相等、密度不等的N2和C2H4 B.等体积、等密度的CO和C2H4
C.等温、等体积的O2和N2 D.等压、等体积的N2和CO2
这道题源于人民教育出版社化学教材第一册53页第二大题第5题,原题如下:
在相同条件下,下列气体中所含分子数目最多的是( )
A.1 g H2 B.10 g O2 C.30 g Cl2 D.17 g NH3
上述两题均为比较数目分子的。课本题目重点考查基本公式:N=nNA,n=m/M。高考题在本题基础上进行了拓展,重点考查阿伏加德罗定律及其推论。不论怎样考查,大家记住气体物质的量的大小决定分子数的多少即可。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com