
题目列表(包括答案和解析)
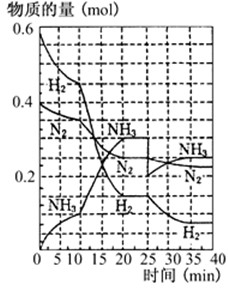 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )| A、反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L?min) | B、从曲线可以看出,反应进行到10min至20min时可能是使用了催化剂 | C、从曲线可以看出,反应进行至25min时,增加了0.1mol氨气 | D、在25min平衡正向移动但达到新平衡后NH3的体积分数比原平衡小 |
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N22NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是

A.反应开始到第一次平衡时,N2的平均反应速率为0.0625 mol·(L·min)-1 ,H2的转化率为75%
B.反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[ c3(H2) ·c(N2)]=(0.15 mol·L-1) 2/[ (0.075 mol·L-1) 3 ·(0.125 mol·L-1)]
C.从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂
D.从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动
500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
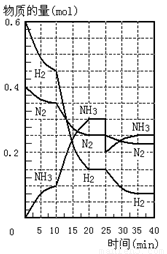
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟时,分离出0.2mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡小
500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中
H2、N2和NH3物质的量变化如图所示,根据题意完成下列各题:
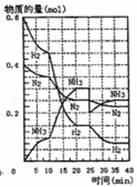
(1)反应达到平衡时,平衡常数表达式K= 此时增加N2的量,平衡常数将 (填“增大”“减小”或“不变”)
(2)500℃、20Mpa时,反应处于平衡状态的时间 。
(3)反应开始到第一次平衡时,N2的平均反应速率为 。
(4)据图判断,反应进行到10min至20min时曲线发生变化的原因是: 反应进行至25min时,曲线发生变化的原因是 。
(08上海12校联考)500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中
H2、N2和NH3物质的量变化如图所示,根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
此时增加N2的量,平衡常数将 (填“增大”
“减小”或“不变”)

(2)500℃、20Mpa时,反应处于平衡状态的时间 。
(3)反应开始到第一次平衡时,N2的平均反应速率为 。
(4)据图判断,反应进行到10min至20min时曲线发生变化的原
因是: 反应进行至25min时,曲线发生变化的
原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com