
题目列表(包括答案和解析)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)分析该反应并回答下列问题:
①平衡常数表达式为K=____________。
②下列各项中,不能说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol CO,同时生成1 mol CH3OH
(2)如图是该反应在不同温度下CO的转化率随时间变化的曲线。
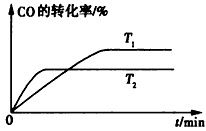
①该反应的焓变△H____(填“>”、“<”或 “=”)0。
②T1和T2温度下的平衡常数大小关系是K1____ (填“>”、“<”或“=”)K2。
③若容器容积不变,下列措施可增加甲醇产率的是____
a.升高温度
b.将CH3OH(g)从体系中分离出来
c.使用合适的催化剂
d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-a kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ/mol
③H2O(g)=H2O(l) △H=-c kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =____kJ/mol。
(4)已知甲醇燃料电池的工作原理如图所示。



| A.该装置内可发生原电池反应 |
| B.该装置中Pt为正极,电极反应为:O2+2H2O+4e-=4OH- |
| C.溶液中会出现红褐色的沉淀 |
| D.该装置中Fe为阴极,电极反应为:Fe—2e-+2OH-=Fe(OH)2 |
有关如图所示装置的叙述不正确的是
A.该装置内可发生原电池反应
B.该装置中Pt为正极,电极反应为:O2+2H2O+4e-=4OH-
C.该装置中Fe为阴极,电极反应为 Fe—2e-+2OH-=Fe(OH)2
D.溶液中会出现红褐色的沉淀

有关如图所示装置的叙述不正确的是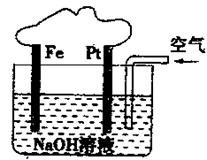
| A.该装置内可发生原电池反应 |
| B.该装置中Pt为正极,电极反应为:O2+2H2O+4e-=4OH- |
| C.溶液中会出现红褐色的沉淀 |
| D.该装置中Fe为阴极,电极反应为:Fe—2e-+2OH-=Fe(OH)2 |
| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
物理部分:
一.选择题
14.ABC 15.AC 16.ACD 17.C 18.C 19.BCD 20.BD 21.D
22.实验题:
(I)①ACD ②AD
(II)①直流毫安表应选 C ,直流电压表应选 D 。
②在方框内画出实验电路图:(分压.外接)
23.解析:(1)由闭合电路欧姆定律:
E=U1+ E=U2+
E=U2+
|