
题目列表(包括答案和解析)
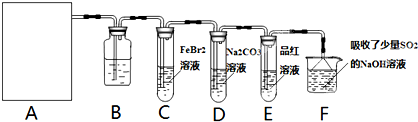
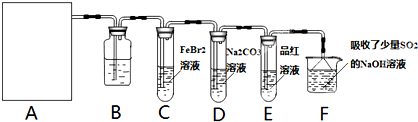
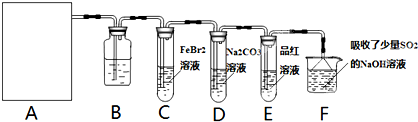
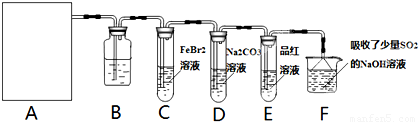
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol?L-1、0.001 mol?L-1, 催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol?L-1)的用量均为2mL。
(1)配平化学方程式:
______KMnO4 +____H2C2O4 +_____H2SO4 → ____K2SO4 +_____MnSO4 +_____CO2 +______H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/ g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和______探究催化剂对该反应速率的影响 |
| ② | | | | |
| ③ | | | | |
| ④ | | 0 | |
| KMnO4酸性溶液 的浓度 / mol?L-1 | 溶液褪色所需时间 t / min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
B
B
A
D
C
C
A
D
B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
C
C
CD
BD
D
BC
B
BD
AC
三、(本题包括3小题,共34分)
19.(11分)
(1)CO32- + H2O
 HCO3- + OH- (2分)(配平、化学式错得0分,写等号扣1分)
HCO3- + OH- (2分)(配平、化学式错得0分,写等号扣1分)
(2)不再有气泡产生(或只有极少量气泡产生) (1分)
(3)若控制不准确温度过高Fe2+易被氧化;由于有氢气生成,明火加热不安全 (2分)
(两个方面各占1分)
(4)4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O (2分) (化学式错得0分,配平错扣1分)
(5)6.6 (2分) (多写单位g不扣分)
(6)循环使用 (2分)(具体说出如何循环使用同样得分,意思相近表达欠清晰扣1分)
20.(11分)
(1)2MnO4- + 5H
(化学式错得0分,配平错扣1分,漏↑扣1分,扣完为止)
(2)4 (2分)
(3)① 反应开始时:c(KMnO4)= =0.00067 mol?L-1 (1分)
=0.00067 mol?L-1 (1分)
反应时间: =
= =6.7min (1分)
=6.7min (1分)
KMnO4的平均反应速率:
ν(KMnO4)= =
= =1×10-4 mol?L-1?min-1 (1分)
=1×10-4 mol?L-1?min-1 (1分)
(一步完成计算且结果正确得3分,结果错误得0分。速率单位错误扣1分)
② 否(或:不可行) (1分) 取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。(3分)
(基本思路错误得0分,思路正确未强调草酸过量扣1分,未强调体积相同扣1分)
21.(12分)
(1)7 (1分)
实验操作
预期现象和结论
步骤1:用药匙取少量白色粉末于试管A底部,点燃酒精灯,充分加热试管。
(1分)
白色粉末减少,有白烟生成,试管上部有白色固体凝结,说明原白色粉末含有NH4Cl。(2分)
步骤2:用药匙取少量试管A中的残留固体于试管B中,滴加适量蒸馏水,振荡。(1分)
固体溶解得无色溶液。(1分)
步骤3:向试管B中滴加过量的 Ba(NO3)2溶液和1mol?L-1硝酸,充分振荡后静置。(2分)
有白色沉淀生成,证明原白色粉末含有 K2SO4。(1分)
步骤4:取试管B中上层清液少量于试管C中,滴加 AgNO3溶液和1mol?L-1硝酸。(2分)
有白色沉淀生成,证明原白色粉末含有NaCl。(1分)
(3)
(NH4Cl的检验用NaOH溶液和红色石蕊试纸同样得3分;另取样品溶于水进行K2SO4的检验同样得2分;NaCl的检验必须包含有上述4个步骤的操作,共6分(着重号为关键点);步骤设计不合理,次序混乱酌情扣分。)
四、(本题包括3小题,共34分)
22.(10分)
(1)①  (1分)
(1分)
② 取形状大小相同的镁片和铝片分别与体积相同、浓度相同的稀盐酸反应,观察产生气泡的快慢 (2分)(操作1分,观察指标1分。着重号部分缺一处扣1分。用金属与沸水反应、等浓度盐溶液碱性比较等合理方法均得分,方案无可行性不给分。)
③ Na2SO3 + SO2 + H2O = 2NaHSO3 (2分)(化学式错得0分,配平错扣1分)
有白色胶状沉淀生成,有无色刺激性气味气体产生 (2分)
(各占1分,着重号部分有缺漏合扣1分)
(2)① H2PO4-、HCO3-、HPO42- (2分) ② 强 (1分)
23.(12分)
(1)Ba2+ + SO42- = BaSO4↓ Mg2+ + 2OH- = Mg(OH)2↓
Ca2+ + CO32- = CaCO3↓ Ba2+ + CO32- = BaCO3↓ (4分)
(每个1分。符号错误、漏↓得0分)
(2)2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑ (2分)
2NaOH + H2↑+ Cl2↑ (2分)
(化学式错得0分,配平错扣1分,漏↑扣1分,漏条件扣1分,扣完为止)
(3)制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种) (2分)
(写对1个得1分。答案多于2个的按前2个答案评分。)
(4)蒸发浓缩(1分) 过滤(1分) (多写冷却不得分也不扣分)
蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解) (2分)
(两个因素各占1分。后者从溶度积角度作答叙述正确也给分。)
24.(12分)
(1)增大 (1分)
(2)向左移 (1分)
 (3)(4分)
(3)(4分)
(各占2分,起点位置、曲线走势、终点与原曲线的相对高低等只要有一处错误则得0分。)
(4)(4分)
0.60(2分)
ν正_>_ν逆(2分)
(5)-787.0 (2分)(不带负号得0分,有效数字不准确扣1分。)
五、(本题包括1小题,共9分)
 25.(9分)
25.(9分)
(1) (2分)(有错即得0分)
 |
(2分)(漏系数n扣1分,漏条件不扣分)
 |
(2) (2分)

(3) (2分)
(漏系数2扣1分,不写条件不扣分)
(4)A、B (2分) (漏选1个扣1分,多选一个也扣1分,扣完为止。)
六、选做题(本题包括2小题,每小题10分。考生只能选做一题)
26.(10分)
 (1)① 碳碳双键、羧基 (2分)(写对一种得1分,错别字不给分,多写一个扣1分)
(1)① 碳碳双键、羧基 (2分)(写对一种得1分,错别字不给分,多写一个扣1分)
② (3分)
(2) (5分)

|