
题目列表(包括答案和解析)
(1)Na2O2与水反应的化学方程式为_________________________,
(2)反应结束时生成气体的体积在标准状况下为_____________ L。
(3)取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为V L,则V的取值范围是_____________(用含a的代数式表示,结果可不化简)。
将15.6 g Na2O2与2.7 g Al粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出).
(1)Na2O2与水反应的化学方程式为________,15.6 g Na2O2在该反应中转移电子的物质的量为________mol.
(2)反应结束时生成气体的体积在标准状况下为________L.
(3)取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为V L,则V的取值范围是________(用含a的代数式表示,结果可不化简).
将15.6 g Na2O2与2.7 g Al粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出).
(1)Na2O2与水反应的化学方程式为________,15.6 g Na2O2在该反应中转移电子的物质的量为________mol.
(2)反应结束时生成气体的体积在标准状况下为________L.
(3)取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为V L,则V的取值范围是________(用含a的代数式表示,结果可不化简).
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
【实验步骤】
I. 按下图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。
 |
II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入A装置中的反应容器,在靠近反应容器口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
III. 用酒精灯微微加热A装置中的反应容器。
【实验现象】
A装置中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
 (1)在A装置中方框内的仪器可以选用 ,(从①②③④⑤中选出所需要的装置,使仪器装置图完整)
(1)在A装置中方框内的仪器可以选用 ,(从①②③④⑤中选出所需要的装置,使仪器装置图完整)
|
(3)通过探究发现,装置A中发生的反应为2Na2O2+C === Na2CO3+X,X物质的化学式
是 。
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种新物质。已知反应过程中转移6.02×1023个电子时,生成53 g Pd,该反应的化学方程式为 。
(5)将装置A中充分反应后所得产物溶于适量水中。
①所得溶液的溶质是 (填化学式)。
②常温,若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为 。
(6)写出Na2O2的一种重要用途 .
(15分)Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
[实验步骤]
I、按下图所示装置(部分仪器未画出)组装仪器,并检查装置气密性。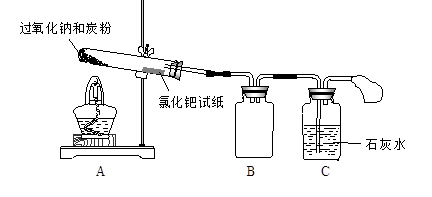
 II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
II. 将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的
氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
III. 用酒精灯微微加热试管底部。
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
(1)装置B的作用是 。
(2)通过探究发现,装置A中只发生反应2Na2O2+C Na2CO3+X,则X为 (填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
Na2CO3+X,则X为 (填化学式),①请设计实验证明产物X的存在,简要写出操作方法、现象和结论:
。
②有人认为炭粉的加入量的多少会影响产物X的检验,请简要说明原因:
(3)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd:Mr=106),同时生成另外两种新物质。已知反应过程中转移6.02×1023个电子时,生成53 g Pd,该反应的化学方程式为 。
(4)将装置A中完全反应后所得物质溶于适量水,配成溶液,回答下列问题:
①溶液中下列关系正确的是 (填字母序号)。
a.c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c.c(Na+)=2[c(CO32-)+c(HCO3-)+ c(H2CO3)]
d.c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-)
②若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com