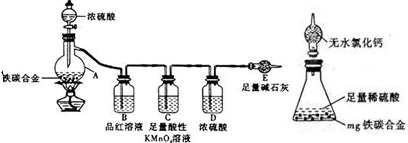
(2012?浦东新区模拟)某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略).请按要求填空:
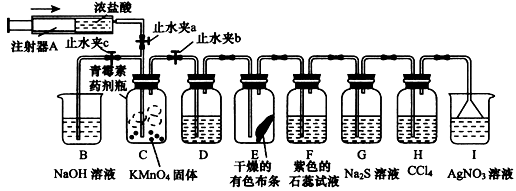
Ⅰ、探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与
D
D
(填装置编号)连接;装置C中的烧瓶内固体宜选用
ad
ad
.
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是
饱和食盐水、浓硫酸
饱和食盐水、浓硫酸
.
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl
2+2NH
3→N
2+6HCl)的反应.实验时打开开关1、3,关闭2,先向烧瓶中通入
氯气
氯气
,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体.实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子
.
Ⅱ、探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl
-和Br
-的还原性强弱,能证明结论的实验现象是
装置E中的NaBr溶液变橙红色
装置E中的NaBr溶液变橙红色
.
(5)若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是
装置E中的NaBr溶液变橙红色.向烧瓶中插入一只温度计,并使温度计水银球没入烧瓶内液面下
装置E中的NaBr溶液变橙红色.向烧瓶中插入一只温度计,并使温度计水银球没入烧瓶内液面下
.
(6)将装置B、C分别与F相连后,进行H
2S与SO
2反应的实验.F的烧瓶中发生反应的化学方程式为
SO2+2H2S=3S↓+2H2O
SO2+2H2S=3S↓+2H2O
;F的烧杯所起的作用是
吸收尾气
吸收尾气
.