
题目列表(包括答案和解析)
化学在能源开发与利用中起着十分关键的作用。
⑴蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
将“可燃冰”从海底取出,“可燃冰”将融化并放出甲烷气体。请你所学的物质结构知识加以解释: 。
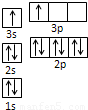
⑵设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。
①已知该电池的负极反应为C4H10+13O226e=4CO2+5H2O,则该电池的正极反应式为 ,电池工作时,固体电解质里的O2-向 极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
⑶能源的紧缺在很大程度上制约了我省的经济发展,请你提出解决江苏省能源紧缺问题的两点建议 。
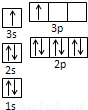
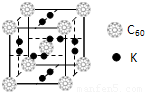
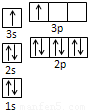
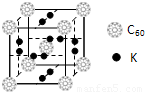
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com