
题目列表(包括答案和解析)
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的气体生成 |
Fe+2H+=H2↑+Fe2+ |
Fe具有还原性 |
② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 |
Fe2+具有还原性 Fe2+具有还原性 |
| ③ | 氯化亚铁溶液加 入锌片 |
锌片溶解,析出铁,溶液从浅绿色变为无色 锌片溶解,析出铁,溶液从浅绿色变为无色 |
Fe2++Zn=Fe+Zn2+ | Fe2+具有氧化性 Fe2+具有氧化性 |
④ |
在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) 在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) |
加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 |
2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ 2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ |
Fe3+具有氧化性 |
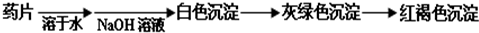
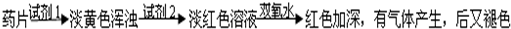
推断化合物的化学性质,常从两个角度分析:Ⅰ、物质的属类(如氧化物、酸、碱或盐等);Ⅱ、组成元素的化合价(是否处于最高价、中间价态或最低价).请回答:
(1)已知SO2是一种酸性氧化物,试写出一个化学方程式表示该物质具有的化学性质________;
(2)根据硝酸中氮元素的化合价,可以预测硝酸一定具有________;(填字母)
A.氧化性
B.还原性
C.既有氧化性又有还原性
D.无法判断
①你推断的理由是________.
②以浓硝酸为例,写出一个符合你预测的化学方程式________.
⑴课本上叙述:“碳、硅、锗、锡的+4价化合物是稳定的.而铅的+2价化合物是稳定的。” 据此判断:锡的+2价化合物(如SnCl2)应具有较强的(填“氧化”或“还原”.下同) 性,铅的+4价化合物应具有较强的 性。PbO2与浓盐酸可发生氧化还原反应生成Cl2,该反应的化学方程式为 。
(2)我国古代炼丹中经常使用到红丹,俗称铅丹。在一定条件下铅丹(用X表示)与硝酸能发生如下反应:X+4HNO3 PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是 ,此铅丹中铅的化合价是 。由此反应可推测PbO是(填“酸”或“碱”) 性氧化物。
PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是 ,此铅丹中铅的化合价是 。由此反应可推测PbO是(填“酸”或“碱”) 性氧化物。
⑶砷酸钠在酸性条件下跟碘化钾溶液反应生成亚砷酸钠(Na3AsO3)、碘单质和水的离子反应方程式是 ,上述反应中电子转移数目是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com