
题目列表(包括答案和解析)
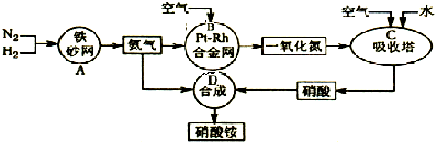
利用相关数据作出的推理或判断一定正确的是
A.用弱酸的电离常数比较相同条件下强碱弱酸盐溶液的碱性强弱
B.用物质的熔沸点数据推断物质的晶体类型
C.根据溶液的pH判断该溶液的酸碱性
D.根据焓变数据判断反应能否自发进行
已知:(NH4)2CO3(s)====NH4HCO3(s)+NH3(g) ΔH="+74.9" kJ·mol-1,下列说法中正确的是( )
| A.该反应中熵变小于0,焓变大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.判断反应能否自发进行需要根据ΔH与ΔS综合考虑 |
已知:(NH4)2CO3(s)====NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1,下列说法中正确的是( )
A.该反应中熵变小于0,焓变大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.判断反应能否自发进行需要根据ΔH与ΔS综合考虑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com