
题目列表(包括答案和解析)
 A、【供选学《化学与生活》考生作答】
A、【供选学《化学与生活》考生作答】| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
| ||
| 2S×7.14 |
| ||
| 2S×7.14 |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一。镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标。某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实 验方案:
验方案:
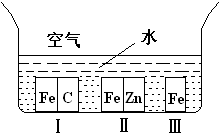
方案一:取三块镀锌铁皮(A、B、C,截自同一块镀锌铁皮),将镀锌铁皮A放入烧杯中,加入40mL 6mol·L—1盐酸,反应时用玻璃棒小心翻动镀锌铁皮,待锌镀层反应完全时,立即将未反应的铁皮取出,洗涤、小心烘干、称量。将B、C重复上面的实验。
(1)锌镀层完全反应的标志是 。
(2)如何检验铁片已经洗净
。
方案二:已知锌与强碱溶液反应的离子方程式为:Zn+2OH—+2H2O=[Zn(OH)4]2—+H2↑。某同学按右图装置设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮放入6mol·L—1 NaOH溶液中。回答下列问题:
(3)装置中导管a的作用是 。
(4)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;②待B中不再有气体产生并恢复至室温;③由A向B中滴加足量NaOH溶液;④上下移动C,使干燥管和C中液面相平。
上述操作的顺序是 (填序号)。
(5)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL(已知Zn的密度为7.14g/cm3,实验条件的气体摩尔体积为Vm L / mol)。则镀锌铁皮的镀层厚度为 cm。(写出数学表达式)
(16分)氨气是一种重要的基础化工原料,用途广泛。
(1)在微电子工业中,氨水可作刻蚀剂H2O2的清除剂,产物不污染环境。该反应的化学方程式为2NH3 + 3H2O2= +6H2O
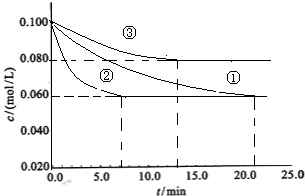
(2)工业中常用以下反应合成氨:N2+3H2 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。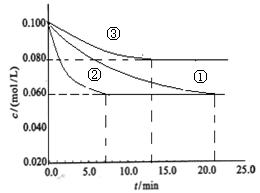
该反应平衡常数的数学表达式为 ;实验②平衡时H2的转化率为_____ 。
(3)据图所示,②、③两装置中各有一个条件与①不同。请指出,并说明判断的理由。
②条件:_______ 理由: ________
③条件:_______ 理由: ________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com