(2013?广东)化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养.
(1)如图1在实验室中用浓盐酸与MnO
2共热制取Cl
2并进行相关实验.
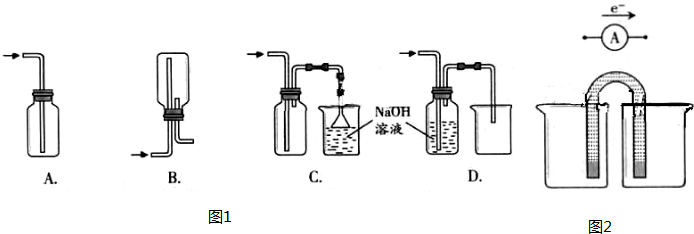
①下列收集Cl
2的正确装置是
C
C
.
②将Cl
2通入水中,所得溶液中具有氧化性的含氯粒子是
Cl2、HClO、ClO-
Cl2、HClO、ClO-
.
③设计实验比较Cl
2和Br
2的氧化性,操作与现象是:取少量新制氯水和CCl
4于试管中,
加入适量的NaBr溶液,充分振荡,静置.溶液分层,
加入适量的NaBr溶液,充分振荡,静置.溶液分层,
同时下层液体颜色为橙色
同时下层液体颜色为橙色
(2)能量之间可以相互转化:电解食盐水制备Cl
2是将电能转化为化学能,而原电池可将化学能转化为电能.设计两种类型的原电池,探究其能量转化效率.
限选材料:ZnSO
4(aq),FeSO
4(aq),CuSO
4(aq);铜片,铁片,锌片和导线.
①完成原电池的甲装置示意图(如图2),并作相应标注.
要求:在同一烧杯中,电极与溶液含相同的金属元素.
②以铜片为电极之一,CuSO
4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极
溶解
溶解
.
③甲乙两种原电池中可更有效地将化学能转化为电能的是
甲
甲
,其原因是
甲为①可以保持电流稳定,化学能基本都转化为电能.而乙为②①②中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能.
甲为①可以保持电流稳定,化学能基本都转化为电能.而乙为②①②中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能.
.
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选
锌片
锌片
作阳极.


