
题目列表(包括答案和解析)
(6分)一定温度下,向一固定容积的密闭容器中充入氢气和溴蒸气发生反应:H2(g)+Br2(g) 2HBr(g)。达到平衡状态后,下列说法中一定正确的是 ;能说明此反应达到平衡状态的是 。
2HBr(g)。达到平衡状态后,下列说法中一定正确的是 ;能说明此反应达到平衡状态的是 。
A.单位时间内生成n mol H2的同时生成2n mol HBr
B.单位时间内生成n mol H2的同时生成n molBr2
C.一个H-H键断裂的同时有两个H-Br键断裂
D.[HBr]∶[H2]∶[Br2]=2∶2∶1
E.温度和体积一定时,某一生成物的浓度不再变化
F.温度和体积一定时,容器内压强不再变化
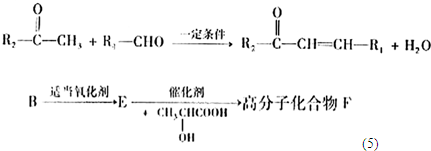
 +
+
| 一定条件 |
 +H2O
+H2O +
+
| 一定条件 |
 +H2O
+H2O

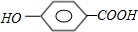 +n
+n
| 催化剂 |
 +(2n-1)H2O
+(2n-1)H2O +n
+n
| 催化剂 |
 +(2n-1)H2O
+(2n-1)H2O +n
+n
| 催化剂 |
 +(2n-1)H2O
+(2n-1)H2O +n
+n
| 催化剂 |
 +(2n-1)H2O
+(2n-1)H2O
| 稀NaOH |
| △ |


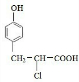

| 一定条件 |

| 一定条件 |

 任意一种
任意一种 任意一种
任意一种
图Ⅰ
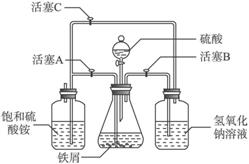
图Ⅱ
请回答下列问题:
(1)图Ⅰ用于制备绿矾。其中锥形瓶中盛放的药品或原料是___________,集气瓶的作用是______________;烧杯中主要发生:①CuSO4+H2S![]() CuS↓+H2SO4
CuS↓+H2SO4
②4CuSO4+PH3+4H2O![]() H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___________,其作用是________________________________________________________________。
H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___________,其作用是________________________________________________________________。
(2)图Ⅱ用于制备硫酸亚铁铵。在0—
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,可制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号 | 反应物用量 | 产品质量 |
1 | n(H2SO4)∶n(Fe)>1∶1 | 介于Ⅰ级—Ⅱ级之间 |
2 | n(H2SO4)∶n(Fe)<1∶1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制_________过量为最佳。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com