
题目列表(包括答案和解析)
化合物CO、HCOOH、 分别燃烧时,消耗氧气与生成CO2的体积之比都是1:2,后两者的分子式可以看成是CO(H2O)和(CO)2H2O。也就是说,只要分子式符合(CO)n(H2O)m。(n与m均为正整数)的各种有机物,它们燃烧时消耗O2和生成CO2的体积比总是1:2。现有一些只含有碳、氢、氧三种元素的有机物,它们燃烧时消耗O2和生成CO2的体积比是3:4。试回答:
分别燃烧时,消耗氧气与生成CO2的体积之比都是1:2,后两者的分子式可以看成是CO(H2O)和(CO)2H2O。也就是说,只要分子式符合(CO)n(H2O)m。(n与m均为正整数)的各种有机物,它们燃烧时消耗O2和生成CO2的体积比总是1:2。现有一些只含有碳、氢、氧三种元素的有机物,它们燃烧时消耗O2和生成CO2的体积比是3:4。试回答:
(1)这些有机物中,分子量最小的化合物的分子式为________。
(2)某2种碳原子数相同的上述有机物,若它们的相对分子质量分别为α和b(α<b),则相对分子质量之差必定是________整数倍。
(3)在这些有机物中有一种化合物含有2个羧基,取0.2625g该化合物,恰好能与25.0ml 0.1mol·L-1的NaOH溶液完全中和。据此,结合必要的计算和推导,写出该有机物的相对分子质量和分子式。
 分别燃烧时,消耗氧气与生成CO2的体积之比都是1:2,后两者的分子式可以看成是CO(H2O)和(CO)2H2O。也就是说,只要分子式符合(CO)n(H2O)m。(n与m均为正整数)的各种有机物,它们燃烧时消耗O2和生成CO2的体积比总是1:2。现有一些只含有碳、氢、氧三种元素的有机物,它们燃烧时消耗O2和生成CO2的体积比是3:4。试回答:
分别燃烧时,消耗氧气与生成CO2的体积之比都是1:2,后两者的分子式可以看成是CO(H2O)和(CO)2H2O。也就是说,只要分子式符合(CO)n(H2O)m。(n与m均为正整数)的各种有机物,它们燃烧时消耗O2和生成CO2的体积比总是1:2。现有一些只含有碳、氢、氧三种元素的有机物,它们燃烧时消耗O2和生成CO2的体积比是3:4。试回答:
(1)这些有机物中,分子量最小的化合物的分子式为________。
(2)某2种碳原子数相同的上述有机物,若它们的相对分子质量分别为α和b(α<b),则相对分子质量之差必定是________整数倍。
(3)在这些有机物中有一种化合物含有2个羧基,取0.2625g该化合物,恰好能与25.0ml 0.1mol·L-1的NaOH溶液完全中和。据此,结合必要的计算和推导,写出该有机物的相对分子质量和分子式。
(1)这些有机物中,分子量最小的化合物的分子式为________。
(2)某2种碳原子数相同的上述有机物,若它们的相对分子质量分别为α和b(α<b),则相对分子质量之差必定是________整数倍。
(3)在这些有机物中有一种化合物含有2个羧基,取0.2625g该化合物,恰好能与25.0ml 0.1mol·L-1的NaOH溶液完全中和。据此,结合必要的计算和推导,写出该有机物的相对分子质量和分子式。
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l);△H1= —1214kJ/mol
②2CO(g)+O2(g)=2CO2(g);△H2= —566kJ/mol
则反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H= 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其正极电极反应式是: 。
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-→H2↑
③若将 所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | a | b | c | 1 |
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
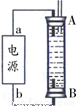
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com