
题目列表(包括答案和解析)
(12分) 设反应①![]() 的平衡常数为
的平衡常数为![]() 。反应②
。反应②![]() 的平衡常数为
的平衡常数为![]() ,在不同温度下,
,在不同温度下,![]() 、
、![]() 的值如下:
的值如下:
| 温度 |
|
|
|
| 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)从上表可以推断:反应①是_______________ (填“吸”、“放”)热反应。
(2)现有反应③![]() 写出该反应的平衡常数K3的数学表达
写出该反应的平衡常数K3的数学表达
式:K![]() =____________。
=____________。
(3)根据反应①与②,可推导出K![]() 、K
、K![]() 与K
与K![]() 之间的关系式_______________。据
之间的关系式_______________。据
![]() 此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应
此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应。问:要使反应
③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___________________
(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图l、2表示该反应③在时刻t![]() 达到平衡、在时刻t
达到平衡、在时刻t![]() 分别因改变某个条件而发生变化的
分别因改变某个条件而发生变化的
情况:
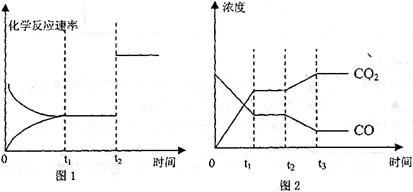
①图l中时刻t![]() 发生改变的条件是________________________________________
发生改变的条件是________________________________________
②图2中时刻t![]() 发生改变的条件是________________________________________
发生改变的条件是________________________________________
I、已知反应:
3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式
 K= 。
K= 。
(2)右图表示反应过程中有关物质的能量,则反应
的 △H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
II、二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。
 根据图示回答下列问题。
根据图示回答下列问题。
①平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,
在体积不变的条件下,下列选项中有利于提高SO2平衡转
化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出氧气
(11分)
(Ⅰ)有可逆反应A(g) + 3B(g)  2C(g) △H<0
2C(g) △H<0
(1)已知该反应的平衡常数表达式:K=[C]2/[A][B]3 ;升高温度,平衡常数K将_______________(填“增大”,“减小”,“不变” )。([X]表示相应物质的浓度)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20 min后又达新平衡。试推测,与原平衡状态相比,第15 min时,V正_______(填“增大”,“减小”,“不变” ),V逆______(填“增大”,“减小”,“不变” )。
(3)该反应的速率与时间的关系如下图所示: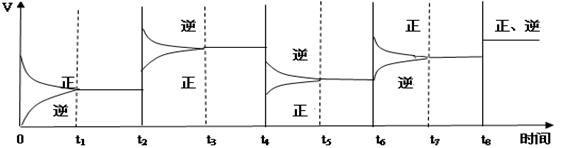
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,请指出改变了什么条件(例如:减小生成物的浓度)
t2时_________ ___;t4时______ _____;t6时___ _______;t8时_______ ____。
(Ⅱ)、一定温度下在体积为5 L的密闭容器中发生可逆反应。
若某可逆反应的化学平衡常数表达式为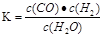
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总的物质的量不随时间而变化 |
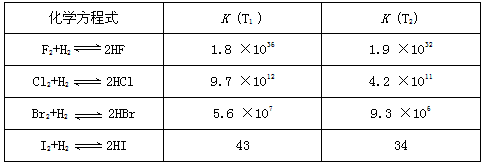
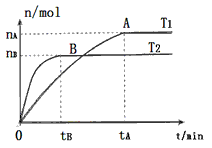
(Ⅰ)有可逆反应A(g) + 3B(g) ![]() 2C(g) △H<0
2C(g) △H<0
(1)已知该反应的平衡常数表达式:K=[C]2/[A][B]3 ;升高温度,平衡常数K将_______________(填“增大”,“减小”,“不变” )。([X]表示相应物质的浓度)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20 min后又达新平衡。试推测,与原平衡状态相比,第15 min时,V正_______(填“增大”,“减小”,“不变” ),V逆______(填“增大”,“减小”,“不变” )。
(3)该反应的速率与时间的关系如下图所示:

可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,请指出改变了什么条件(例如:减小生成物的浓度)
t2时_________ ___;t4时______ _____;t6时___ _______;t8时_______ ____。
(Ⅱ)、一定温度下在体积为5 L的密闭容器中发生可逆反应。
![]() 若某可逆反应的化学平衡常数表达式为:
若某可逆反应的化学平衡常数表达式为:
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化 B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化 D. 容器中总的物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com