
题目列表(包括答案和解析)
A.该氮的氧化物所含电子数为偶数
B.该氮的氧化物可由Cu与浓HNO3反应获得
C.该氮的氧化物是自然固氮的一种产物
D.该氮的氧化物中氮元素的质量分数为0.636
(16分)氮的氧化物(用NOx表示)是大气污染物,必须加以处理。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:_ _____________。
_____________。
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。
Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:__________(填仪器序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
| 试剂组合序号 | 固体试剂/g | NH3体积/mL |
| a | 12.0g Ca(OH)2(过量) 10.8g NH4Cl | 2688 |
| b | 12.0g Ca (OH)2(过量) 10.8g(NH4)2SO4 (OH)2(过量) 10.8g(NH4)2SO4 | 2728 |
| c | 12.0g NaOH(过量) 10.8g NH4Cl | 3136 |
| d | 12.0g NaOH(过量) 10.8g (NH4)2SO4 | 3118 |
| e | 12.0g CaO(过量) 10.8g NH4Cl | 3506 |
| f | 12.0g CaO(过量) 10.8g (NH4)2SO4 | 3584 |

 ____________。
____________。 某氮肥厂氨氮废水中的氮元素多以NH4+和![]() 的形式存在,该废水的处理流程如下:
的形式存在,该废水的处理流程如下:![]()
(1) 过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用: 。
②用化学平衡原理解释通空气的目的: 。
(2) 过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
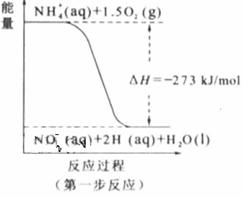
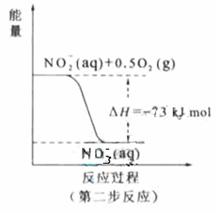
①第一步反应是 反应(选题“放热”或“吸热”),判断依据是 。
②1mol NH4+(aq)全部氧化成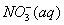 的热化学方程式是 。
的热化学方程式是 。
(3) 过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗![]() 转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
(8分)氮氧化物(如NO2、NO等)进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾.因此必须对含有氮氧化物的废气进行处理.
(1)用氢氧化钠溶液可吸收废气中的氮氧化物.反应的化学方程式如下:
NO2 +NO+2NaOH═2NaNO2+H2O ①2NO2 + 2NaOH═NaNO2+ NaNO3 + H2O ②
在反应①中,产物NaNO2中N元素的化合价为 ,氧化剂与还原剂的质量之比为 ;在反应②中,氧化剂是 ,还原剂是 。
(2)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使他们发生反应生成无毒气体,该反应的化学方程式为 。
(3)亚硝酸钠
氨气(NH3)也可用来处理氮氧化物.例如,氨气与二氧化氮反应:8NH3+6NO2═7N2+12H2O.
若某工厂排出废气中NO2含量为0.5%(体积分数),则处理1.0×103米3(标准状况)这种废气,需要 千克氨气 (计算结果保留2位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com