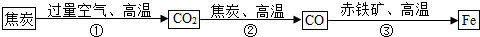钢铁是重要的金属材料,在生产、生活中有广泛的用途.
(1)钢铁属于
(填“纯净物”或“混合物”).
(2)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失.在日常生活中,小明发现切过咸菜的菜刀更容易生锈.为了验证该现象,小明做了下列实验:
取两支试管,分别放上一个相同铁钉,在一支试管中加入
,在另一支试管中加入等体积的
,一周后小明观察实验现象,得到了与日常生活中相同的结果,他的结论是:水中溶有
.
(3)为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法.这些方法都能防止锈蚀的共同原理是
.
(4)铁螺丝放入足量的稀盐酸中,观察到铁锈逐渐消失,该反应的化学方程式为:
;
一段时间后,又观察到铁钉表面有气泡产生,写出产生气泡的化学方程式:
;
长时间反应后,溶液中有黑色颗粒沉淀,该物质是
,把该物质从溶液中分离出来的方法是
.
(5)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
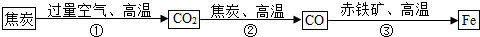
请写出第③步反应的化学方程式:
;
(6)金属矿物的储量有限,而且不能再生,所以废钢铁要
.
(7)一同学联想到家里铜制餐具上有一层绿色物质,认为铜在空气中也会生锈.他们上网查阅资料,知道这种绿色物质的化学成分为Cu
2(OH)
2CO
3(铜绿).他们从铜绿组成和空气的成分大胆猜测,铜生锈除了与铁生锈条件相同外,还应该有CO
2参加反应.
请写出铜在空气中生成铜绿的化学方程式
.
(8)将盛有等质量、等质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的铝和铁(提示:铝与盐酸反应生成氯化铝和氢气),待反应停止后,请判断:
若天平仍保持平衡,烧杯中一定没有剩余的物质是
;
若天平失去平衡,则指针一定偏向
的一侧.