
题目列表(包括答案和解析)
(13分)(1)钠镁铝三种元素中第一电离能最大的是 。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。
(3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
| A.NH4Cl晶体 | B.Na3AlF6晶体 | C.Na2CO3?10H2O晶体 |
| D.CuSO4溶液 E. CH3COOH溶液 |
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 159 | 418 | 945 |
| | 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4 °C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素电负性由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,1 mol B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
说明:O摄氏度=273K
【解析】原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
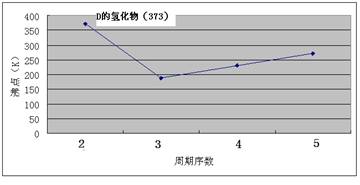
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个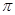 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
(12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素电负性由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,1 mol B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
说明:O摄氏度=273K
【解析】原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个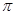 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
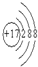
| ||
| ||
| ||
| ||
 TiCl4+2CO
TiCl4+2CO  H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1  H=-566 kJ·mol-1
H=-566 kJ·mol-1  H=+141 kJ·mol-1
H=+141 kJ·mol-1  H=______________,
H=______________, 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因_______________(用适当化学方程式辅以必要的文字说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因_______________(用适当化学方程式辅以必要的文字说明)。 Mg+Cl2 TiCl4+2Mg
Mg+Cl2 TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti 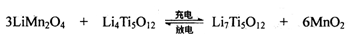 使用时先充电,写出其充电式的阳极反应_______________,放电时Li+的移动方向 _______________。
使用时先充电,写出其充电式的阳极反应_______________,放电时Li+的移动方向 _______________。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com