
题目列表(包括答案和解析)
 实验室配制500mL 0.4mol/L的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.4mol/L的NaCl溶液,有如下操作步骤:实验室配制100ml 0.2mol/L的NaCl溶液
(1)本实验所需的仪器为(填序号)②
①量筒 ②托盘天平 ③烧杯 ④漏斗 ⑤250ml 容量瓶 ⑥ 100ml容量瓶 ⑦药匙 ⑧ 胶头滴管
除上述仪器中可使用的以外,还缺少的仪器 。它在该实验中的用途中
① 。② 。
(2)在使用容量瓶之前必须进行的操作是: 在容量瓶中标有①温度,② ,③ 三个特征标志。
(3)请写出该实验的实验步骤。
①计算,②称量,③ ,④ ,⑤ ,⑥定容。
(4)在实验过程中出现如下情况应该该如何处理
①加蒸馏水时不慎超过刻度线应 。
②加蒸馏水到刻度线以下1cm至2cm处应
③向容量瓶中倾倒溶液时应
实验室配制100ml 0.2mol/L的NaCl溶液
(1)本实验所需的仪器为(填序号)②
① 量筒 ② 托盘天平 ③烧杯 ④ 漏斗 ⑤250ml 容量瓶 ⑥ 100ml容量瓶 ⑦药匙 ⑧ 胶头滴管
除上述仪器中可使用的以外,还缺少的仪器 。它在该实验中的用途中
① 。② 。
(2)在使用容量瓶之前必须进行的操作是: 在容量瓶中标有①温度,② , ③ 三个特征标志。
(3)请写出该实验的实验步骤。
①计算,②称量,③ ,④ ,⑤ ,⑥定容。
(4)在实验过程中出现如下情况应该该如何处理
①加蒸馏水时不慎超过刻度线应 。
②加蒸馏水到刻度线以下1cm至2cm处应
③向容量瓶中倾倒溶液时应
 实验室配制500mL 0.4mol/L的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.4mol/L的NaCl溶液,有如下操作步骤: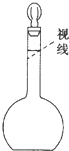
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com