
题目列表(包括答案和解析)


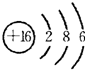

| ||
| ||


 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-

| ||
| ||
| ||

| ||
| ||
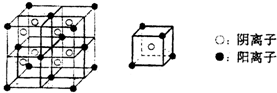 A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:
A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:| C | |
| E |
Ⅱ.(15)解析:本题为实验评价和分析题,要求学生明确实验的各环节及要求.(1)实验材料的准备中要明确本实验的观测指数是体温的变化,因此要对实验的小白鼠体温进行前测.实验中要遵循重复性原则,以防止偶然性的发生,减少对实验的影响。(2)在实验设计中可以进行自身前后对照,但要注意操作的先后顺序安排。(3)小白鼠是恒温动物,其体温调节是神经和体液调节共同作用的结果,与体液调节相关的激素主要是肾上腺素和甲状腺激素。(4)小白鼠是恒温动物,当外界温度降低时,其体温保持相对平衡,为维持体温,体内物质氧化加强,产生更多能量,需要消耗更多O2;当外界温度升高时,其体温保持相对平衡,为维持体温,体内物质氧化减弱,减少能量的产生,需要消耗O2的量也减少。
参考答案(15分)(1)①实验前要先测定甲、乙鼠的体温 (2分) ②实验要有重复性,仅用两只小白鼠进行实验有一定的偶然性。(2分)⑵赞同。(1分)先做不破坏下丘脑的实验,再做破坏下丘脑后的实验,进行自身前后对照(2分)⑶甲状腺激素和肾上腺素(2分,缺一不给分) 神经?体液(2分)⑷BD (2分,缺一不给分) AC (2分,缺一不给分)
考后反思:代谢特别是植物细胞的光合作用等知识一直是各类考试的热点,在各类考试中分值比例也较高。在解答此问题时要注意以下几点:反映光合作用的各种物理量的关系;复习时要利用表格、图解等熟记相关知识,同时提高迁移能力。动物生命活动调节也是高考的常考点。在复习时要将理论和实验结合起来。
.files/image165.jpg) 31.Ⅰ.(6分)现有两种纯种植物,一种只能合成药物1,另一种两种药物都不能合成,这两种植物杂交,F1都只能合成药物1,F1自交后,产生的F2中三种表现型及比例是:只能合成药物1:两种药物都能合成:两种药物都不能合成=9∶3∶4。请回答有关问题:
31.Ⅰ.(6分)现有两种纯种植物,一种只能合成药物1,另一种两种药物都不能合成,这两种植物杂交,F1都只能合成药物1,F1自交后,产生的F2中三种表现型及比例是:只能合成药物1:两种药物都能合成:两种药物都不能合成=9∶3∶4。请回答有关问题:
(1)能正确表示F1中两对基因位置的是图( ).files/image167.jpg)
(2)F2能合成两种药物的植株中能稳定遗传的占 。
(3)用上述方法选育能合成两种药物的植株费时较长,若想在较短时间内培育出该种植株,最好选用的育种方法是 。
(4)若想利用大肠杆菌生产药物1,需选择 的途径获得目的基因,然后用 和 分别进行剪切和拼接,形成重组DNA分子后将其导入到大肠杆菌中,使目的基因得到表达。
Ⅱ.(14分)果蝇是遗传学研究中一种重要的实验材料,请回答下列相关的问题:
(1)下表列出了人类、果蝇重性染色体组成与性别的关系。由表可知,Y染色体只在 (填“人”或“果蝇”)的性别决定中起主导作用。
性染色体组成
XY
XX
XXY
XO
人的性别
雄
雌
雄
雌
果蝇的性别
雄
雌
雌
雄
(2)果蝇的灰身(B)对黑身(b)为显性,基因位于常染色体上,红眼(R)对白眼(r)为显性,基因位于X染色体上,表现型均为红眼灰身的雌果蝇与雄果蝇交配,后代出现了红眼灰身、红眼黑身、白眼灰身、白眼黑身四中表现型,问:
①亲本雌性的基因型为: 。
②雄性亲本产生的精子基因型为 。
(3)一只雌果蝇的一条染色体上某基因发生了突变,使野生型性状变为突变型性状。该雌果蝇与野生型雄果蝇杂交,F1的雌雄个体均既有野生型又有突变型。
①在野生型和突变型这对相对性状中,隐性性状是 。
②根据上述杂交实验的结果能否确定突变基因在X染色体上还是在常染色体上?请简要说明推断过程。
③若要通过一次杂交实验鉴别突变基因在X染色体上还是在常染色体上,如果选择F1中野生型(雌)作为杂交的亲本之一,则雄性亲本应选择F1中的 型。
31Ⅰ(6分)解析: (1)从题目和图可知,控制药物生成的基因有两对,即Aa、Bb,又由F1自交后,产生的F2后代表现型及比例符合基因自由组合定律,说明这两对基因位于非同源染色体上。
(2)两种药物都不能合成基因型为aa _,药物1基因型为A B_ , 两种药物都能合成基因型为A__bb, F2中能合成两种药物的植株中能稳定遗传的基因型为AAbb,由F1自交后, F2中只能合成药物1:两种药物都能合成:两种药物都不能合成=9∶3∶4,推知F1基因为AaBb,F1自交能合成两种药物的植株基因型为A_ bb占F2中的3/4×1/4,且AAbb占F2中的1/4×1/4,那么AAbb/A bb=1/3。
(3)根据育种方法中能明显缩短育种年限的方法是单倍体育种。
(4)利用工程菌生产药物应运用发酵工程,发酵工程菌种的选育有三类:诱变育种、基因工程、细胞工程,结合题中信息,运用基因工程技术进行选育。其步骤有四:提取目的基因(直接从体细胞分离如原核细胞的基因,人工合成基因如反转录法或化学合成法),目的基因与运载体结合,将目的基因导入受体细胞,目的基因的检测和表达。
参考答案(每空1分)(1)A (2)1/3 (3)单倍体育种 (4)人工合成基因(反转录法或化学合成法) 限制性内切酶 DNA连接酶
Ⅱ(每空2分)解析:(1)从图表中可以看出,在人类中只要有Y染色体,不管有几条X染色体,都为男性,而在果蝇中XXY的为雌性,而XO型的却为雄性,由此可知Y染色体只在人的性别决定中起主导作用。(2)B、b和R、r两对基因分别位于两对染色体上,遗传时遵循自由组合定律。因而雌性的基因型为BbXRXr ,雄性的基因型为BbXRY,形成的配子为四种。(3) 一只雌果蝇的一条染色体上某基因发生了突变,使野生型性状变为突变型性状,只能解释为显性突变,即:aa→Aa,因此突变性为显性性状。突变型雌果蝇与野生型雄果蝇杂交,F1的雌雄个体均既有野生型又有突变型,不能判断出基因在常染色体还是在X染色体上,因为:Aa×aa 、 XRXr× XrY 两种情况下后代雌雄个体均有两种类型。若要通过一次杂交实验鉴别突变基因在X染色体上还是在常染色体上,选择F1中野生型(雌)作为杂交的亲本之一,则雄性亲本应选择F1中的突变型。如果后代雌雄各有两种类型,说明基因在常染色体上,如果后代雌性全部为突变型,雄性全部为野生型,则基因在X染色体上。
参考答案:(每空2分)(1)人(2)①BbXRXr ② BXR BY bXR bY (3)①野生型 ②不能;Aa×aa 、 XRXr×XrY 两种情况下后代雌雄个体均有两种类型 ③突变
考后反思:遗传和变异是高中生物学的重点、又是难点,高考试题该部分占的比例,历年都较大,是出活题考能力的主角。遗传的物质基础、遗传的基本规律和生物的变异,在全书中占有重要位置。它不仅有重要的理论价值,而且在实践中与人类的生产生活关系极为密切。从近几年高考试题看,DNA(基因)的结构和功能、孟德尔遗传实验过程、分子水平的解释、遗传图谱的判定、遗传病发病几率计算等内容,特别是将减数分裂过程,人类基因组计划、用物理或化学方法进行的诱变育种;突变过程与不同基因的传递过程联系在一起,是命制大型综合题的素材。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com